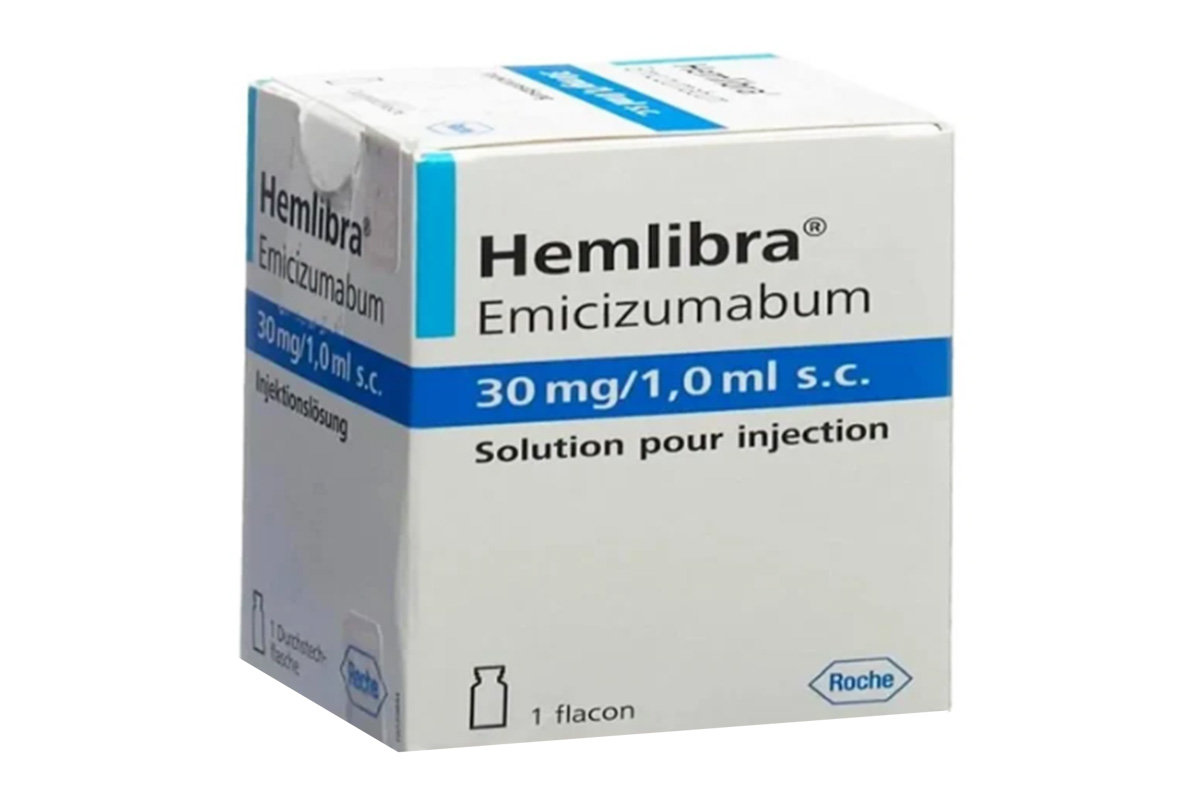



艾美赛珠单抗(Emicizumab)
图片来源: 图片来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供参考。
艾美赛珠单抗由瑞士罗氏制药公司研发,作为一款双特异性抗体药物,最早于2017年获美国FDA批准上市,用于治疗A型血友病患者。其独特机制为血友病治疗带来新突破,获得了医学界的高度关注。
在国外,多家媒体和学术期刊持续报道该药物的临床进展与应用效果。部分新闻提到,艾美赛珠单抗显著降低患者出血率,并改善生活质量,也推动了全球范围内对血友病治疗模式的重新审视。在国内也已获批上市,但尚未纳入医保报销。

艾美赛珠单抗是一种人源化单克隆修饰免疫球蛋白G4(IgG4)双特异性抗体,可同时结合凝血因子IXa和因子X,通过桥接激活的因子IX和因子X,恢复因凝血因子VIII缺乏而受损的止血功能,用于血友病A患者的出血预防。
药品称呼
通用名称:艾美赛珠单抗、Emicizumab
商品名称:Hemlibra
其他名称:艾米珠单抗、舒友立乐
适应靶点
凝血因子IXa、凝血因子X
适应症和适应人群
适用于成人和儿童(包括新生儿及以上)血友病A(先天性凝血因子VIII缺乏)患者,无论是否存在凝血因子VIII抑制剂,作为常规预防用药,以预防或减少出血发作的频率。
规格与性状
规格:注射剂,单剂量小瓶包装,注射剂,30mg/1mL/盒。
性状:无菌、无防腐剂的无色至淡黄色溶液。
主要成分
活性成分:艾美赛珠单抗(emicizumab-kxwh)
辅料:L-精氨酸、L-组氨酸、泊洛沙姆188,用L-天冬氨酸调节pH至6.0(不同规格辅料含量按比例调整)。
用法用量
1.推荐剂量
仅供皮下注射使用。
负荷剂量:前4周,每周一次,每次3mg/kg。
维持剂量:4周后可选择以下任一方案(由医护人员根据患者依从性等因素决定):1.5mg/kg,每周一次;3mg/kg,每两周一次;6mg/kg,每四周一次。
开始使用艾美赛珠单抗预防治疗前1天,应停用预防性旁路制剂。预防治疗的第一周,可继续使用预防性凝血因子VIII(FVIII)产品。
2.漏服处理
若漏用一剂,应尽快补用,随后恢复常规给药计划。不得在同一天给予两剂以弥补漏服剂量。
3.制备和给药说明
艾美赛珠单抗需在医护人员指导下使用。经适当培训后,患者或其照料者可自行注射(需医护人员评估适宜性),但7岁以下儿童不建议自行注射。
给药前检查:给药前需目视检查药液,若存在可见颗粒或变色(非无色至淡黄色),不得使用。
器具选择:
抽取药液需使用带过滤器的转移针和注射器,注射需使用注射针;
剂量≤1mL时,使用1mL注射器(透明聚丙烯或聚碳酸酯材质,Luer-Lock接口,刻度0.01mL,无菌、一次性、无乳胶、无热原);
剂量>1mL且≤2mL时,使用2mL或3mL注射器(透明聚丙烯或聚碳酸酯材质,Luer-Lock接口,刻度0.1mL,无菌、一次性、无乳胶、无热原);
转移针:不锈钢材质,Luer-Lock接口,18号,长度1-1.5英寸,单斜面或半钝针尖,一次性,无乳胶,含5微米过滤器,无热原;
注射针:不锈钢材质,Luer-Lock接口,26号(可接受25-27号),长度优选3/8英寸(最大1/2英寸),一次性,无乳胶,无热原,含安全装置。
注射部位:每次注射应选择与前次不同的解剖部位(上臂外侧、大腿或腹部任意象限),不得注射于痣、瘢痕、皮肤压痛、瘀青、发红、硬化或破损处。上臂外侧注射仅由照料者或医护人员操作。
药液处理:单剂量小瓶中剩余药液需丢弃,不得混合不同浓度(如30mg/mL和150mg/mL)的小瓶药液。
具体您可以阅读艾美赛珠单抗完整用法用量信息,建议在医生的指导下正确用药。推荐文章:艾美赛珠单抗的用法用量。
不良反应
1.临床试验常见反应(发生率≥10%)
注射部位反应(22%):包括瘀青、不适、红斑、血肿、硬结、疼痛、瘙痒、皮疹、肿胀、荨麻疹、发热等,多为轻至中度,93%可自行缓解;头痛(15%);关节痛(15%)。
2.严重不良反应
血栓性微血管病(TMA):接受艾美赛珠单抗预防治疗的患者中,当活化凝血酶原复合物浓缩物(aPCC)累计剂量平均>100U/kg/24小时且持续24小时以上时可能发生,表现为血小板减少、微血管病性溶血性贫血、急性肾损伤等,停药后1周内可改善;
血栓事件:上述aPCC使用条件下可能发生,表现为血管内血栓形成,停药后1个月内可改善或缓解;
免疫原性:5.1%的患者出现抗艾美赛珠单抗抗体,少数(<1%)因中和抗体导致药效丧失(如突破性出血增加)。
3.其他反应
少见反应(<1%):横纹肌溶解症(与体力活动增加相关,无肾或肌肉症状);
上市后报告:皮肤及皮下组织异常(皮疹、荨麻疹、血管性水肿)、免疫系统异常(超敏反应)。
具体您可以阅读艾美赛珠单抗完整副作用信息,建议在医生的指导下正确用药。推荐文章:艾美赛珠单抗的副作用。
注意事项
1.与aPCC相关的血栓性微血管病
使用aPCC时需权衡获益与风险,因艾美赛珠单抗半衰期长,停药后6个月内仍可能与aPCC发生相互作用。给药期间需监测TMA症状(如血小板减少、溶血、肾损伤),若出现需立即停用aPCC并暂停艾美赛珠单抗,缓解后是否重启需个体化评估。
2.与aPCC相关的血栓栓塞
使用aPCC时需监测血栓事件(如肢体肿胀、胸痛、头痛等),若出现需立即停用aPCC并暂停艾美赛珠单抗,缓解后是否重启需个体化评估。
3.免疫原性
若患者出现药效丧失(如突破性出血增加),需及时评估是否为中和抗体所致,必要时调整治疗方案。
4.实验室凝血试验干扰
艾美赛珠单抗会干扰部分凝血相关检测,如ACT、aPTT、aPTT基础的单因子测定(如FVIII活性)、APC-R、Bethesda法FVIII抑制物等,这些结果不能用于监测药物活性或调整治疗。不受影响的检测包括牛源性显色Bethesda法、TT、PT基础的单因子测定、非FVIII显色法单因子测定及免疫学方法(如ELISA、比浊法)。
特殊人群用药
【孕妇】尚无孕妇使用数据,动物研究未评估生殖毒性。仅在潜在获益大于对胎儿的潜在风险时使用。
【哺乳期女性】未知艾美赛珠单抗是否进入人乳。鉴于人IgG可进入乳汁,需权衡母乳喂养的益处与母亲治疗需求及对婴儿的潜在风险。
【具有生殖潜力的男性和女性】有生育潜力的女性在治疗期间需采取避孕措施。
【儿童使用】新生儿及以上儿童患者的安全性和有效性已确立。6个月以下婴儿的稳态血药浓度可能低于年长儿童(低19%-33%),不良反应类型与成人相似。
【老年人使用】临床试验中65岁及以上患者数量不足,无法确定其反应是否与年轻患者不同,现有临床经验未发现差异。
【肾功能损害】轻(肌酐清除率60-89mL/min)、中度(30-59mL/min)肾损害患者的药代动力学无显著变化,重度肾损害患者未研究。
【肝功能损害】轻(总胆红素≤1.5×ULN,AST任意值)、中度(总胆红素1.5-3×ULN,AST任意值)肝损害患者的药代动力学无显著变化,重度肝损害患者未研究。
禁忌症
尚不明确。
药物相互作用
1.与aPCC联用的高凝风险
艾美赛珠单抗与aPCC联用可能增加血栓性微血管病和血栓事件风险。
2.与实验室检查的相互作用
艾美赛珠单抗可缩短内源性凝血途径相关试验的凝血时间(如aPTT),干扰基于这些试验的检测结果(如一期法FVIII活性);显色法FVIII活性试验中,含人凝血因子的试剂可能高估艾美赛珠单抗的止血潜力,含牛凝血因子的试剂对艾美赛珠单抗不敏感,可用于监测内源性或输注的FVIII活性及FVIII抑制物。
凝血法Bethesda试验可能出现假阴性,需用牛源性显色法Bethesda试验替代。艾美赛珠单抗对凝血的影响在停药后可持续6个月。
药物过量
说明书中尚未明确。
药代动力学
吸收:皮下注射后吸收半衰期为1.6±1天,1mg/kg剂量的绝对生物利用度为80.4%-93.1%,腹部、上臂、大腿注射的药代动力学相似。
分布:表观分布容积均值为10.4L(变异系数26.0%)。
消除:表观清除率均值为0.27L/天(变异系数28.4%),消除半衰期均值为26.9±9.1天。
剂量比例:0.3-6mg/kg剂量范围内呈线性药代动力学。
稳态浓度:负荷剂量(3mg/kg每周一次,持续4周)后,第5周trough浓度均值为52.6±13.6μg/mL;维持剂量下的稳态浓度参见说明书。
特殊人群:年龄(1-77岁)、种族、是否存在FVIII抑制物、轻中度肝/肾功能损害对药代动力学无显著影响;体重增加时清除率和分布容积增加,按mg/kg给药可维持相似暴露量。
贮存方法
避光保存于原包装中,冷藏(2-8℃),不得冷冻或摇晃。
未开封小瓶可暂存于30℃以下环境,总时长不超过7天,可放回冷藏。
药液从瓶中取出后需立即使用,剩余药液丢弃。
研发公司
瑞士罗氏
参考资料:FDA说明书更新于2025年7月,FDA说明书网址:https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=761083
[ 免责声明 ] 本页面内容来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供持有医疗专业资质的人员用于医学药学研究参考,不构成任何治疗建议或药品推荐。所涉药品可能未在中国大陆获批上市,不适用于中国境内销售和使用。如需治疗,请咨询正规医疗机构。本站不提供药品销售或代购服务。
- 艾美赛珠单抗(Emicizumab)的适应症及用药指南艾美赛珠单抗(Emicizumab、Hemlibra)由瑞士罗氏研发生产,是血友...[ 详情 ]推荐指数:2342026-01-13 17:52
- 艾美赛珠单抗(Emicizumab)的用法用量艾美赛珠单抗(Emicizumab)是一种人源化单克隆修饰免疫球蛋白G4(IgG...[ 详情 ]推荐指数:5632025-10-09 15:03:14
- 艾美赛珠单抗(Emicizumab)的用药指南艾美赛珠单抗(Emicizumab)由瑞士罗氏制药公司研发,作为一款双特异性抗体...[ 详情 ]推荐指数:5852025-10-09 15:03:59
- 艾美赛珠单抗(Emicizumab)怎么购买艾美赛珠单抗(Emicizumab)是一种双特异性抗体药物,显著降低患者出血率,...[ 详情 ]推荐指数:4482025-09-30 12:52
- 艾美赛珠单抗(Emicizumab)2025年最新价格是多少钱一盒?艾美赛珠单抗(Emicizumab)由瑞士罗氏制药公司研发,是一种双特异性抗体药...[ 详情 ]推荐指数:6112025-09-30 12:52
- 艾美赛珠单抗(Emicizumab)国内价格是多少艾美赛珠单抗(Emicizumab)是一种突破性的双特异性抗体药物,由瑞士罗氏制...[ 详情 ]推荐指数:5672025-09-30 12:52
- 艾美赛珠单抗(Emicizumab)的注意事项和药物相互作用有哪些艾美赛珠单抗(Emicizumab)是一种人源化单克隆修饰免疫球蛋白G4(IgG...[ 详情 ]推荐指数:4902025-09-30 12:52
- 艾美赛珠单抗(Emicizumab)是治疗什么疾病的艾美赛珠单抗(Emicizumab)是一款革命性的预防性治疗药物,为血友病A患者...[ 详情 ]推荐指数:5152025-10-01 09:07
- PM8002联合紫杉醇对比化疗二线治疗小细胞肺癌[适 应 症]小细胞肺癌[试验分期]Ⅱ期
- ES102联合特瑞普利单抗治疗晚期非小细胞肺癌[适 应 症]非小细胞肺癌[试验分期]Ⅱ期
- 比较Sigvotatug Vedotin与多西他赛治疗既往经治的非小细胞肺癌的研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- QL2107或Keytruda®联合化疗治疗转移性非鳞状非小细胞肺癌的临床研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- LM-299注射液单药或联合其它抗肿瘤药物治疗晚期实体瘤[适 应 症]实体瘤[试验分期]Ⅰ期
- SH-1028片对比安慰剂用于非小细胞肺癌辅助治疗[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
做您身边的贴心健康咨询管家

了解医药信息 关注临床动态
- 1奎扎替尼(quizartinib)用法用量已帮助6人2026-02-26 16:37:23
- 2奎扎替尼(quizartinib)的药代动力学已帮助12人2026-02-26 16:37:13
- 3依普利酮(Eplerenone)的用法用量已帮助9人2026-02-26 17:46
- 4黄体酮胶囊(Progesterone)的功效与作用已帮助11人2026-02-26 17:46
- 5硼替佐米(Velcade)国内能买到吗?在哪能买到?已帮助11人2026-02-26 17:28
- 6硼替佐米(Velcade)如何用药已帮助15人2026-02-26 17:07
- 7硼替佐米(Velcade)的用药指南已帮助16人2026-02-26 17:07
- 8硼替佐米(Velcade)怎么购买已帮助13人2026-02-26 16:37
- 92026年硼替佐米(Velcade)最新价格是多少钱一盒?已帮助16人2026-02-26 16:31
- 10硼替佐米(Velcade)的注意事项和药物相互作用已帮助25人2026-02-26 16:19
- 11硼替佐米(Velcade)是治疗什么疾病的已帮助15人2026-02-26 15:54
- 12硼替佐米(Velcade)的副作用如何缓解已帮助25人2026-02-26 15:26
 幽门螺旋杆菌根除治疗药(Vonosap Pack)适用于治疗对阿莫西林和克拉霉素敏感的幽门螺旋杆菌...[ 详情 ]
幽门螺旋杆菌根除治疗药(Vonosap Pack)适用于治疗对阿莫西林和克拉霉素敏感的幽门螺旋杆菌...[ 详情 ] 卡左双巴缓释片(Sinemet)适用于治疗原发性帕金森病、脑炎后帕金森综合征,以...[ 详情 ]
卡左双巴缓释片(Sinemet)适用于治疗原发性帕金森病、脑炎后帕金森综合征,以...[ 详情 ] 神经妥乐平片(Neurotropin)患有带状疱疹后神经痛、腰痛症、颈肩腕综合征、肩关...[ 详情 ]
神经妥乐平片(Neurotropin)患有带状疱疹后神经痛、腰痛症、颈肩腕综合征、肩关...[ 详情 ] 甲氧沙林软膏(Oxsoralen)诊断为寻常性白斑,且无相关禁忌症的成人和儿童患者...[ 详情 ]
甲氧沙林软膏(Oxsoralen)诊断为寻常性白斑,且无相关禁忌症的成人和儿童患者...[ 详情 ]



 医伴旅服务热线:
医伴旅服务热线:
































