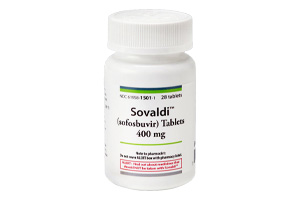
FDA批准Sovaldi用于慢性丙型肝炎治疗

2013年12月6日——美国食品药品监督管理局(FDA)批准Sovaldi(索磷布韦)用于治疗慢性丙型肝炎病毒(HCV)感染。Sovaldi是首款被证实无需联用干扰素,即可对特定类型丙肝感染具备安全性与有效性的药物。
美国FDA药品评价与研究中心抗菌产品办公室主任爱德华・考克斯医学博士表示:“此次批准标志着部分慢性丙肝患者的治疗模式发生了重大转变。”Sovaldi是FDA在过去两周内批准的第二款慢性丙肝治疗药物。此前在11月22日,FDA刚批准了奥莱森(西咪匹韦)。
丙型肝炎是一种可引发肝脏炎症的病毒性疾病,病情进展可能导致肝功能下降甚至肝衰竭。多数丙肝病毒感染者在肝脏损伤显现前并无明显症状,这一过程可能长达数年。部分慢性丙肝患者会在多年后出现肝纤维化及肝功能受损(肝硬化),进而引发出血、黄疸(眼白或皮肤发黄)、腹腔积液、感染或肝癌等并发症。Sovaldi属于核苷酸类聚合酶抑制剂,可阻断丙肝病毒复制所需的特定蛋白。该药物需作为慢性丙肝联合抗病毒治疗方案的组分使用。丙肝病毒存在多种基因型,患者的具体治疗方案需依据病毒基因型确定,可选择Sovaldi联合利巴韦林,或Sovaldi联合利巴韦林与聚乙二醇干扰素α。利巴韦林与聚乙二醇干扰素α均为临床常用的丙肝治疗药物。
Sovaldi的疗效通过6项临床试验验证,共纳入1947例受试者,包括未接受过丙肝治疗的初治患者、既往治疗失败的经治患者,以及丙肝/艾滋病病毒共感染患者。临床试验以治疗结束后至少12周血液中未检测到丙肝病毒(即持续病毒学应答)作为判定治愈的标准。
所有临床试验结果显示,含Sovaldi的治疗方案对多种基因型丙肝病毒感染均有效。此外,该药物在无法耐受或不适用干扰素治疗方案的患者,以及等待肝移植的肝癌合并丙肝患者中也展现出疗效,满足了这类患者未被满足的医疗需求。
接受Sovaldi联合利巴韦林治疗的受试者,最常见的不良反应为乏力和头痛;接受Sovaldi联合利巴韦林与聚乙二醇干扰素α治疗的受试者,最常见的不良反应为乏力、头痛、恶心、失眠和贫血。
Sovaldi是FDA批准的第三款获得突破性疗法认定的药物。突破性疗法认定是FDA应药物研发企业申请授予的资质,授予对象为针对严重或危及生命疾病、且初步临床证据显示其疗效显著优于现有疗法的药物。Sovaldi的上市申请通过FDA优先审评程序完成审核,该程序专为治疗严重疾病、且获批后能显著提升安全性或有效性的药物提供加速审评通道。
参考资料: https://www.drugs.com/newdrugs/fda-approves-sovaldi-chronic-hepatitis-c-3986.html
[ 免责声明 ] 本页面内容来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供持有医疗专业资质的人员用于医学药学研究参考,不构成任何治疗建议或药品推荐。所涉药品可能未在中国大陆获批上市,不适用于中国境内销售和使用。如需治疗,请咨询正规医疗机构。本站不提供药品销售或代购服务。
免费询价

- FDA批准Sovaldi用于慢性丙型肝炎治疗2013年12月6日——美国食品药品监督管理局(FDA)批准Sovaldi(索磷...[ 详情 ]推荐指数:5132025-12-26 13:48:09
- FDA批准Sovaldi(索磷布韦)用于治疗12岁及以上慢性丙型肝炎儿童患者加利福尼亚州福斯特城——2017年4月7日——吉利德科学公司宣布,美国食品药品监...[ 详情 ]推荐指数:5152025-12-26 13:47:26
- 吉一代治疗期间,患者生活中也需要注意一些事项丙肝的治疗应该尽早的进行诊断,确诊后应该今早的接受治疗,如果患者错过了丙肝的最佳...[ 详情 ]推荐指数:12272025-01-21 02:49:24
- 吉一代优势有哪些?对丙肝患者来说,对这款吉一代肯定不会陌生,吉一代是一款治疗丙肝效果较为显著的药物...[ 详情 ]推荐指数:10422025-01-20 13:34:31
- 丙型肝炎治疗最新药物进口药索磷布韦效果怎么样?核苷酸类似物抑制剂索磷布韦,也就是吉利德一代(吉一代),该药通过阻断丙型肝炎病毒...[ 详情 ]推荐指数:10272025-01-20 05:54:21
- 索磷布韦片多少钱一瓶,索磷布韦价格索磷布韦是一款治疗成人与12至<18岁青少年的慢性丙型肝炎病毒(HCV)感...[ 详情 ]推荐指数:13302025-01-21 09:39:14
- 索磷布韦能治疗肝硬化吗?针对丙肝病毒特定靶点作用的直接抗病毒药物索磷布韦片,是蛋白酶抑制剂,那么,索磷布...[ 详情 ]推荐指数:8882025-01-21 09:35:59
- 索磷布韦多少钱一盒,索磷布韦最新价格表由吉利德(Gilead)研发的索磷布韦于2013年在美国上市,是一种新型的丙肝特...[ 详情 ]推荐指数:11982025-01-21 02:42:29
- 吉一代应该怎么服用?成人推荐剂量为每日一次,每次口服一片400mg片剂,随食物服用。与吉一代合用时,...[ 详情 ]已帮助1439人2023-10-30 20:57:43
- 索磷布韦能治好丙肝吗?索磷布韦开创了不用干扰素治疗慢性丙型肝炎的先河,通过有效抑制病毒复制,实现了丙型...[ 详情 ]已帮助1370人2023-10-10 10:19:14
- 索磷布韦必须吃三盒吗?索磷布韦片的用法用量是成人推荐剂量为每日一次,每次口服一片400mg片剂,随食物...[ 详情 ]已帮助1450人2023-11-15 03:12:11
- PM8002联合紫杉醇对比化疗二线治疗小细胞肺癌[适 应 症]小细胞肺癌[试验分期]Ⅱ期
- ES102联合特瑞普利单抗治疗晚期非小细胞肺癌[适 应 症]非小细胞肺癌[试验分期]Ⅱ期
- 比较Sigvotatug Vedotin与多西他赛治疗既往经治的非小细胞肺癌的研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- QL2107或Keytruda®联合化疗治疗转移性非鳞状非小细胞肺癌的临床研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- LM-299注射液单药或联合其它抗肿瘤药物治疗晚期实体瘤[适 应 症]实体瘤[试验分期]Ⅰ期
- SH-1028片对比安慰剂用于非小细胞肺癌辅助治疗[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
做您身边的贴心健康咨询管家

了解医药信息 关注临床动态
- 1罗氟司特(roflumilast)的注意事项和药物相互作用已帮助6人2026-02-09 17:51
- 2普纳替尼(Ponatinib)的作用功效及注意事项已帮助6人2026-02-09 17:21
- 3比美替尼(Binimetinib)的适应症以及注意事项已帮助4人2026-02-09 17:04
- 4丁苯那嗪(Xenazine)是治疗什么疾病的已帮助16人2026-02-09 16:21
- 5塞瓦替尼(Hyrnuo)的副作用和不良反应已帮助6人2026-02-09 16:00:10
- 6塞瓦替尼(Hyrnuo)的用法用量:用药指南,剂量调整,特殊人群用药已帮助8人2026-02-09 15:59:57
- 7塞瓦替尼(Hyrnuo)中文说明书已帮助9人2026-02-09 15:59:42
- 8塞瓦替尼(Hyrnuo)的详细说明书:作用与功效,用法用量,副作用,注意事项等已帮助8人2026-02-09 17:09:14
- 9丁苯那嗪(Xenazine)的副作用如何缓解已帮助14人2026-02-09 15:57
- 10丁苯那嗪(Xenazine)的用药注意事项已帮助14人2026-02-09 15:03
- 11丁苯那嗪(Xenazine)的功效与作用已帮助16人2026-02-09 13:32
- 12美国FDA接受塞瓦替尼(Hyrnuo)针对HER2突变非小细胞肺癌的新药申请并授予优先审评资格已帮助9人2026-02-09 13:26
 甲氧沙林片(Oxoralen)确诊为寻常性白癜风,且适合接受PUVA疗法的患者...[ 详情 ]
甲氧沙林片(Oxoralen)确诊为寻常性白癜风,且适合接受PUVA疗法的患者...[ 详情 ] Kygevvi(Doxecitine and doxirbitmine)适用于治疗症状发作年龄在12岁及以下的成人和儿科...[ 详情 ]
Kygevvi(Doxecitine and doxirbitmine)适用于治疗症状发作年龄在12岁及以下的成人和儿科...[ 详情 ] 贫血铁叶酸维生素片(Faichi)经评估需要补充铁、叶酸及维生素B12的15岁及以...[ 详情 ]
贫血铁叶酸维生素片(Faichi)经评估需要补充铁、叶酸及维生素B12的15岁及以...[ 详情 ] 倍他米松栓剂(Linderon)经诊断确诊为溃疡性结肠炎且病变局限于直肠的成年患...[ 详情 ]
倍他米松栓剂(Linderon)经诊断确诊为溃疡性结肠炎且病变局限于直肠的成年患...[ 详情 ]