达拉非尼 简要说明书

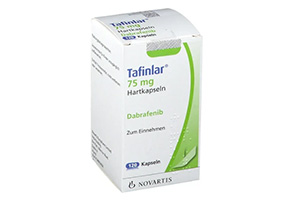
通用名称:达拉非尼
商品名称:Tafinlar
全部名称:dabrafenib,达拉非尼,甲磺酸达拉非尼胶囊, Tafinlar
适应证和用途:
1)TAFINLAR是一种激酶抑制剂适用于有不能切除或转移黑色素瘤与用FDA-批准测试检测BRAF V600E 突变患者的治疗。
2)TAFINLAR与曲美替尼联用是适用为有被FDA批准检验检出BRAF V600E或V600K突变有不可切除的或转移黑色素瘤患者的治疗。联合的使用是根据显示持久反应率。 尚未证实对TAFINLAR与曲美替尼联用疾病相关的症状和总体生存的改善。
使用的限制:TAFINLAR不适用为野生型BRAF-抑制剂治疗患者的治疗。
剂量和给药方法:
1)TAFINLAR作为单药开始治疗前确证在肿瘤标本中存在BRAF V600E突变。TAFINLAR与曲美替尼开始联用治疗前确认肿瘤样品中存在BRAF V600E或V600K突变。
2)TAFINLAR的推荐剂量是150 mg口服每天2次作为单药或与曲美替尼联用2 mg口服每天1次。餐前至少1小时和餐后至少2小时服用TAFINLAR 。
剂型和规格:胶囊:50 mg,75 mg.
禁忌证:无。
警告和注意事项:
1)新原发恶性病,皮肤和非皮肤:当TAFINLAR被使用与曲美替尼联用可能发生。TAFINLAR治疗开始前和用治疗,和联合治疗终止后监视患者新恶性病。
2)在BRAF野生型黑色素瘤促进肿瘤:用BRAF抑制剂可能发生细胞增殖增加。
3)出血:接受TAFINLAR与曲美替尼联用患者可能发生重大出血事件。监视出血体征和症状。
4)静脉血栓栓塞:接受TAFINLAR与曲美替尼联用患者可能发生深静脉血栓形成和肺栓塞。
5)心肌病:TAFINLAR与曲美替尼联用治疗前,治疗后1个月,其后然后每2至3个月评估LVEF。
6)眼毒性:对任何视力障碍进行眼科评价。
7)严重发热反应:当TAFINLAR与曲美替尼联用时可能发生。
8)严重皮肤毒性:监视皮肤毒性和继发感染。对不可耐受的2级,和3和4级皮疹尽管中断TAFINLAR 3周内不改善中断用药。
9)高血糖:在预先存在糖尿病和高血糖患者监视血清糖水平。
10)葡萄糖-6-磷酸脱氢酶缺乏:密切监视溶血性贫血。
11)胚胎胎儿毒性:可能致胎儿危害。忠告有生殖潜能女性对胎儿风险。TAFINLAR可能使激素性避孕药低效和应使用另外避孕方法。
不良反应:
1)对TAFINLAR作为单药最常见不良反应(≥20%)是角化过度,头痛,发热,关节炎,乳头状瘤,脱发,和掌跖红肿疼痛综合征。
2)TAFINLAR与曲美替尼联用最常见不良反应(≥20%)包括发热,畏寒,疲乏,皮疹,恶心,呕吐,腹泻,腹痛,外周性水肿,咳嗽,头痛,关节痛,夜汗,食欲减低,便秘,和肌痛。
药物相互作用 :
1)避免同时给予CYP3A4和CYP2C8的强抑制剂。
2)避免同时给予CYP3A4和CYP2C8强诱导剂。
3)同时使用药物是CYP3A4,CYP2C8,CYP2C9,CYP2C19,和CYP2B6敏感底物,导致这些药物丧失疗效。
特殊人群中使用:
1)哺乳母亲:终止药物和哺乳。
2)有生殖潜能女性和男性:忠告女性患者治疗期间和终止治疗后共2周使用高效避孕。忠告有生殖潜能男性患者精子生成受损潜在风险。
参考资料: FDA说明书,FDA更新于2025年04月07日的说明书,https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=217514
[ 免责声明 ] 以上内容整理于FDA说明书、DRUGS及网络,仅作信息交流之目的,文中观点不代表医伴旅立场,亦不代表医伴旅支持或反对文中观点。本文也不是治疗方案推荐。页面内容仅供医学药学专业人士阅读参考,具体用药请咨询主治医师,本站只做信息展示,不销售药品。如需获得治疗方案指导,请前往正规医院就诊。
添加好友

- 达拉非尼(Tafinlar)说明书达拉非尼(Tafinlar)说明书通用名称:达拉非尼商品名称:Tafinlar全...[ 详情 ]推荐指数:10242025-01-21 17:15:23
- 达拉非尼联合曲美替尼治疗黑色素瘤是需要注意哪些事项?黑色素瘤起源于患者身上一个不起眼的“痣”,由于患者的疏忽,黑色素瘤发现时基本已经...[ 详情 ]推荐指数:10662025-01-21 09:07:24
- 黑色素瘤服用达拉非尼和曲美替尼联合治疗效果如何?诺华宣布,三期多中心COMBI-AD研究的最新数据,评估达拉非尼(甲磺酸达拉非尼...[ 详情 ]推荐指数:10122025-01-21 17:58:50
- 达拉非尼联合治疗方案是可以用作BRAF基因型非小细胞肺癌达拉非尼(甲磺酸达拉非尼胶囊,dabrafenib,Tafinlar)是一种被海...[ 详情 ]推荐指数:7342025-01-21 04:34:05
- 服用达拉非尼期间会有小概率出现虹膜炎等眼部症状达拉非尼(甲磺酸达拉非尼胶囊,dabrafenib,Tafinlar)是我们黑色...[ 详情 ]推荐指数:7382025-01-20 17:04:57
- 达拉非尼使用时的不良反应有哪些?黑色素瘤是一种比较罕见,但是发病率比较低的恶性肿瘤,在病情的早期有很容易被人忽视...[ 详情 ]推荐指数:6972025-01-21 08:33:17
- 达拉非尼联合其他药物服用需预防静脉血栓栓塞达拉非尼(甲磺酸达拉非尼胶囊,dabrafenib,Tafinlar)是一个被美...[ 详情 ]推荐指数:8982025-01-21 14:37:46
- 达拉非尼联合曲美替尼治疗晚期肺癌有效率为64%在一项二期临床试验纳入了36名携带BRAFV600突变,而未接受过其他药物治疗的...[ 详情 ]推荐指数:9402025-01-21 15:11:18
- 问达拉非尼效果好吗?去哪能买到?答达拉非尼是靶向治疗药,2013年就由美国食品药品监督管理局批准了用于治疗转移性黑...[ 详情 ]已帮助1311人2023-11-16 05:31:37
- 问达拉非尼吃了有什么副作用?答达拉非尼单药最常见达拉非尼不良反应(≥20%)是头痛,发热,关节炎,乳头状瘤,脱...[ 详情 ]已帮助1173人2023-10-08 03:36:20
- 问达拉非尼曲美替尼这两种药的效果怎么样?答达拉非尼联合曲美替尼可以联合治疗黑色素瘤,在研究中发现曲美替尼和达拉非尼进行联合...[ 详情 ]已帮助2189人2023-11-07 08:32:31
- 问达拉非尼治疗效果可靠吗?答一项临床3期试验中,入组了870名接受完全手术切除后的BRAFV600E/K突变...[ 详情 ]已帮助1254人2023-11-15 07:34:26
- 问达拉非尼耐药后的治疗方案是什么?答患者在服用达拉非尼(Tafinlar)耐药后,应到医院详细身体检查,医生会根据患...[ 详情 ]已帮助1226人2023-11-02 06:48:48
- 问达拉非尼可以医保报销吗?医保后的价格是多少答达拉非尼已经在国内上市,因此患者可以在国内的药店或医院药房购买到该药品。并且达拉...[ 详情 ]已帮助1991人2023-11-15 15:08:10
- 问达拉非尼治疗效果可靠吗?答一项临床3期试验中,入组了870名接受完全手术切除后的BRAFV600E/K突变...[ 详情 ]已帮助1207人2023-09-29 10:33:47
- 问达拉非尼能延长生存期吗?疗效好吗答一项开放标签、III型随机对照试验。共招募704名BRAFV600突变的转移的黑...[ 详情 ]已帮助1211人2023-10-02 22:53:05
- 【2型糖尿病】UBT251注射液[适 应 症]2型糖尿病[试验分期]Ⅱ期
- 【肝癌】ZG005联合甲苯磺酸多纳非尼片[适 应 症]肝癌[试验分期]Ⅰ期,Ⅱ期
- 【宫颈癌】抗PD-1/TIGIT双抗ZG005[适 应 症]宫颈癌[试验分期]Ⅰ期
- 小分子多靶点激酶抑制剂TT-00420单药或联合治疗晚期实体瘤患者[适 应 症]实体瘤[试验分期]Ⅰ期
- 选择性聚焦型多靶点激酶抑制剂TT-00420片招募晚期恶性实体瘤患者[适 应 症]实体瘤[试验分期]Ⅰ期,Ⅱ期
- 【额纹医美】注射用重组 III 型人胶原蛋白凝胶[适 应 症]其他[试验分期]Ⅰ期
做您身边的贴心健康咨询管家

了解医药信息 关注临床动态
- 12025年福巴替尼正版的价格是多少?已帮助人数19人2025-06-20 17:42
- 2佩玛贝特在哪里买比较靠谱?已帮助人数22人2025-06-20 17:42
- 3全网公布的佩玛贝特2025年最新价格已帮助人数16人2025-06-20 17:42
- 4佩玛贝特正品有合适的购买方式吗?已帮助人数18人2025-06-20 17:28
- 5佩玛贝特原研药和仿制药价格一览已帮助人数18人2025-06-20 17:28
- 6佩玛贝特全新购买方式一览已帮助人数23人2025-06-20 17:16
- 7佩玛贝特最新公布价格表已帮助人数14人2025-06-20 16:53
- 8依利格鲁司一个疗程几盒?多少钱?已帮助人数19人2025-06-20 16:23
- 9依利格鲁司一次能囤几盒?多少钱?已帮助人数19人2025-06-20 16:19
- 10依利格鲁司在中国上市了吗?好购买吗?已帮助人数18人2025-06-20 16:19
- 11依利格鲁司有几种规格?多少钱?已帮助人数14人2025-06-20 15:59
- 12依利格鲁司多少钱一盒?在哪里购买?已帮助人数18人2025-06-20 15:59
 帕克替尼(Pacritinib)帕克替尼适用于治疗血小板计数低于50×1...[ 详情 ]
帕克替尼(Pacritinib)帕克替尼适用于治疗血小板计数低于50×1...[ 详情 ] 地塞米松(GALEN)成人多发性骨髓瘤(MM):需与其他抗骨髓...[ 详情 ]
地塞米松(GALEN)成人多发性骨髓瘤(MM):需与其他抗骨髓...[ 详情 ] 普托马尼(pretomanid)普托马尼需与贝达喹啉(bedaquili...[ 详情 ]
普托马尼(pretomanid)普托马尼需与贝达喹啉(bedaquili...[ 详情 ] 艾加莫德(Vyvgart)适用于治疗成人中抗乙酰胆碱受体(AChR...[ 详情 ]
艾加莫德(Vyvgart)适用于治疗成人中抗乙酰胆碱受体(AChR...[ 详情 ]