辉瑞旗下Ibrance(帕博西尼)获FDA批准扩大适应症,用于治疗HR阳性、HER2阴性转移性乳腺癌

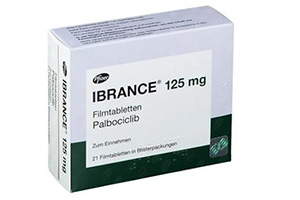
2016年2月19日,辉瑞公司宣布,美国食品药品监督管理局(FDA)已批准其转移性乳腺癌治疗药物Ibrance(帕博西尼)125毫克胶囊的新适应症。自此,Ibrance可联合氟维司群,用于治疗接受内分泌治疗后疾病进展的激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)的晚期或转移性乳腺癌女性患者。
Ibrance新适应症获批依据
基于Ⅲ期PALOMA-3临床试验的结果,辉瑞针对Ibrance提交的补充新药申请(sNDA)获得了FDA突破性疗法认定和优先审评资格,该试验纳入了绝经前、围绝经期及绝经后HR+、HER2-转移性乳腺癌女性患者,这些患者均在辅助治疗或转移性治疗阶段接受过内分泌治疗且疾病发生进展。
Ibrance适应症获批历史
Ibrance于2015年2月首次获批,此前获批适应症为联合来曲唑,作为绝经后女性HR+、HER2-晚期或转移性乳腺癌的初始内分泌治疗方案。该联合来曲唑的适应症基于无进展生存期(PFS)数据获得加速批准,其持续批准可能取决于确证性临床试验中对临床获益的验证与说明。目前,确证性Ⅲ期临床试验PALOMA-2已完成全部患者入组。
关于Ⅲ期PALOMA-3临床试验
Ⅲ期PALOMA-3临床试验共纳入521名乳腺癌女性患者,不受绝经状态限制,按2:1的比例随机分组,分别接受Ibrance联合氟维司群治疗,或安慰剂联合氟维司群治疗。
Ibrance的注意事项
Ibrance的警示与注意事项包括中性粒细胞减少、肺栓塞以及胚胎-胎儿毒性。在PALOMA-3临床试验中,Ibrance联合氟维司群治疗组与氟维司群联合安慰剂治疗组报告的所有级别的常见不良反应(发生率≥10%)如下:中性粒细胞减少(83%vs4%)、白细胞减少(53%vs5%)、感染(47%vs31%)、疲劳(41%vs29%)、恶心(34%vs28%)、贫血(30%vs13%)、口腔炎(28%vs13%)、头痛(26%vs20%)、腹泻(24%vs19%)、血小板减少(23%vs0%)、便秘(20%vs16%)、呕吐(19%vs15%)、脱发(18%vs6%)、皮疹(17%vs6%)、食欲下降(16%vs8%)以及发热(13%vs5%)。更多信息详见下文Ibrance的重要安全信息。
关于Ibrance两种联合治疗方案
美国国家综合癌症网络(NCCN)指南推荐了Ibrance(哌柏西利)的两种联合治疗方案:Ibrance联合来曲唑方案被列为2A类推荐,用于绝经后HR+、HER2-转移性乳腺癌女性患者的一线治疗;Ibrance联合氟维司群方案被列为1类推荐,用于接受内分泌治疗后疾病进展的绝经后HR+、HER2-转移性乳腺癌女性患者。
关于Ibrance(帕博西尼)125毫克胶囊
Ibrance是一种口服CDK4/6抑制剂,CDK4/6是调控细胞周期、推动细胞分裂增殖的关键因子。其适应症为联合来曲唑,用于绝经后女性HR+、HER2-晚期或转移性乳腺癌的初始内分泌治疗;或联合氟维司群,用于接受内分泌治疗后疾病进展的HR+、HER2-晚期或转移性乳腺癌女性患者治疗。其中联合来曲唑的适应症基于无进展生存期数据获得加速批准,该适应症的持续批准将取决于确证性临床试验对临床获益的验证与说明。
参考资料: https://www.drugs.com/newdrugs/pfizer-receives-expanded-fda-approval-ibrance-palbociclib-hr-her2-metastatic-breast-cancer-4345.html
[ 免责声明 ] 本页面内容来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供持有医疗专业资质的人员用于医学药学研究参考,不构成任何治疗建议或药品推荐。所涉药品可能未在中国大陆获批上市,不适用于中国境内销售和使用。如需治疗,请咨询正规医疗机构。本站不提供药品销售或代购服务。
免费询价

- 帕博西尼(Ibrance)获美国食品药品监督管理局常规批准,且一线治疗激素受体阳性、人表皮生长因子受体2阴性转移性乳腺癌适应症扩大2017年3月31日,辉瑞公司宣布,基于确证性3期临床试验PALOMA-2的研究...[ 详情 ]推荐指数:2682026-01-08 14:40:30
- 辉瑞旗下Ibrance(帕博西尼)获FDA批准扩大适应症,用于治疗HR阳性、HER2阴性转移性乳腺癌2016年2月19日,辉瑞公司宣布,美国食品药品监督管理局(FDA)已批准其转移...[ 详情 ]推荐指数:2772026-01-08 14:40
- FDA批准Ibrance(帕博西尼)用于治疗绝经后晚期乳腺癌女性患者2015年2月3日,美国食品药品监督管理局(FDA)授予Ibrance(帕博西尼...[ 详情 ]推荐指数:3202026-01-08 14:37
- 帕博西尼(palbociclib)详细说明书:适应症、用法用量、不良反应、注意事项、特殊人群用药帕博西尼(palbociclib)是一种口服的细胞周期蛋白依赖性激酶(CDK)4...[ 详情 ]推荐指数:2542026-01-08 16:48:23
- 帕博西尼(Ibrance)中文说明书帕博西尼(商品名:Ibrance)是一种新型抗增殖性抗肿瘤药物,属于细胞周期蛋白...[ 详情 ]推荐指数:2792026-01-08 16:46:20
- 帕博西尼(palbociclib)不良反应与副作用帕博西尼在发挥治疗作用的同时,可能引发部分不良反应。此类不良反应虽并非全部会出现...[ 详情 ]推荐指数:3072026-01-08 14:35
- 帕博西尼(palbociclib)用法用量及特殊人群用药指南帕博西尼(Palbociclib)是一种用于治疗激素受体阳性、HER2阴性晚期乳...[ 详情 ]推荐指数:2502026-01-08 16:49:19
- 哌柏西利(帕博西尼)多少钱一盒哌柏西利也称为帕博西尼,用于治疗激素受体阳性、HER2阴性的局部晚期或转移性乳腺...[ 详情 ]推荐指数:11042025-03-20 17:11
- 帕博西尼治疗乳腺癌需要长期吃吗?帕博西尼治疗乳腺癌通常需要长期服用。帕博西尼与激素治疗联合使用,用于在激素治疗后...[ 详情 ]已帮助854人2024-04-19 11:32
- 帕博西尼能用医保报销多少?帕博西尼已经被纳入国家医保药品目录,具体的报销比例因地区、医保政策、病情和购药条...[ 详情 ]已帮助856人2024-04-19 11:29
- 帕博西尼有哪些版本?据了解,在众多帕博西尼版本中,印度海德隆、孟加拉碧康药厂以及孟加拉伊思达药厂版本...[ 详情 ]已帮助876人2025-08-18 13:37:52
- 帕博西尼(爱博新)是什么药?帕博西尼是一种口服的细胞周期蛋白依赖性激酶(DCK4/CDK6)小分子抑制剂,由...[ 详情 ]已帮助851人2024-02-29 15:43
- 帕博西尼常见副作用及处理措施?帕博西尼最常见的副作用为为中性粒细胞减少、感染、白细胞减少、疲劳、恶心、口腔炎、...[ 详情 ]已帮助851人2024-02-29 15:43
- 帕博西尼进医保后价格多少?根据网络信息可得,帕博西尼胶囊的医保价格根据不同剂量而有所不同。125mg*21...[ 详情 ]已帮助888人2024-02-29 15:43
- 帕博西尼(palbociclib)是蛋白酶体抑制剂吗?帕博西尼(palbociclib)是蛋白酶体抑制剂。周期蛋白依赖性激酶(CDK)...[ 详情 ]已帮助829人2024-01-03 10:05
- 吃帕博西尼(palbociclib)胸部难受正常吗?吃帕博西尼(palbociclib)胸部难受可能是正常情况。帕博西尼(palbo...[ 详情 ]已帮助844人2024-01-03 10:05
- PM8002联合紫杉醇对比化疗二线治疗小细胞肺癌[适 应 症]小细胞肺癌[试验分期]Ⅱ期
- ES102联合特瑞普利单抗治疗晚期非小细胞肺癌[适 应 症]非小细胞肺癌[试验分期]Ⅱ期
- 比较Sigvotatug Vedotin与多西他赛治疗既往经治的非小细胞肺癌的研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- QL2107或Keytruda®联合化疗治疗转移性非鳞状非小细胞肺癌的临床研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- LM-299注射液单药或联合其它抗肿瘤药物治疗晚期实体瘤[适 应 症]实体瘤[试验分期]Ⅰ期
- SH-1028片对比安慰剂用于非小细胞肺癌辅助治疗[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
做您身边的贴心健康咨询管家

了解医药信息 关注临床动态
- 1丁苯那嗪(Xenazine)怎么购买已帮助4人2026-02-19 18:52
- 2丁苯那嗪(Xenazine)的用法用量已帮助4人2026-02-19 18:52
- 3丁苯那嗪(Xenazine)的用药指南已帮助4人2026-02-19 18:51
- 4盐酸文拉法辛缓释胶囊(Venlafaxine)国内价格是多少已帮助5人2026-02-19 18:51
- 5盐酸文拉法辛缓释胶囊(Venlafaxine)在哪有已帮助5人2026-02-19 18:51
- 6盐酸文拉法辛缓释胶囊(Venlafaxine)的用药指南已帮助8人2026-02-19 18:51
- 7盐酸文拉法辛缓释胶囊(Venlafaxine)如何用药已帮助13人2026-02-18 18:43
- 8盐酸文拉法辛缓释胶囊(Venlafaxine)国内能买到吗?在哪能买到?已帮助10人2026-02-18 18:43
- 9盐酸司来吉兰(Eldepryl)国内价格是多少已帮助7人2026-02-18 18:43
- 10盐酸司来吉兰(Eldepryl)怎么购买已帮助6人2026-02-18 18:43
- 11盐酸司来吉兰(Eldepryl)的用法用量已帮助8人2026-02-18 18:43
- 12盐酸司来吉兰(Eldepryl)的用药指南已帮助6人2026-02-18 18:43
 日本维生素c(Cinal)适用于消耗性疾病、妊娠期、哺乳期等状态下,因膳食...[ 详情 ]
日本维生素c(Cinal)适用于消耗性疾病、妊娠期、哺乳期等状态下,因膳食...[ 详情 ] 雌二醇片(Julina)适用于缓解更年期障碍及卵巢缺失引发的相关症状,包...[ 详情 ]
雌二醇片(Julina)适用于缓解更年期障碍及卵巢缺失引发的相关症状,包...[ 详情 ] 黄体酮胶囊(Progesterone)具有完整子宫的女性;处于更年期或卵巢功能缺失状态...[ 详情 ]
黄体酮胶囊(Progesterone)具有完整子宫的女性;处于更年期或卵巢功能缺失状态...[ 详情 ] A型肉毒毒素(Dysport)适用于成人颈肌张力障碍、65岁以下成人中重度眉间...[ 详情 ]
A型肉毒毒素(Dysport)适用于成人颈肌张力障碍、65岁以下成人中重度眉间...[ 详情 ]