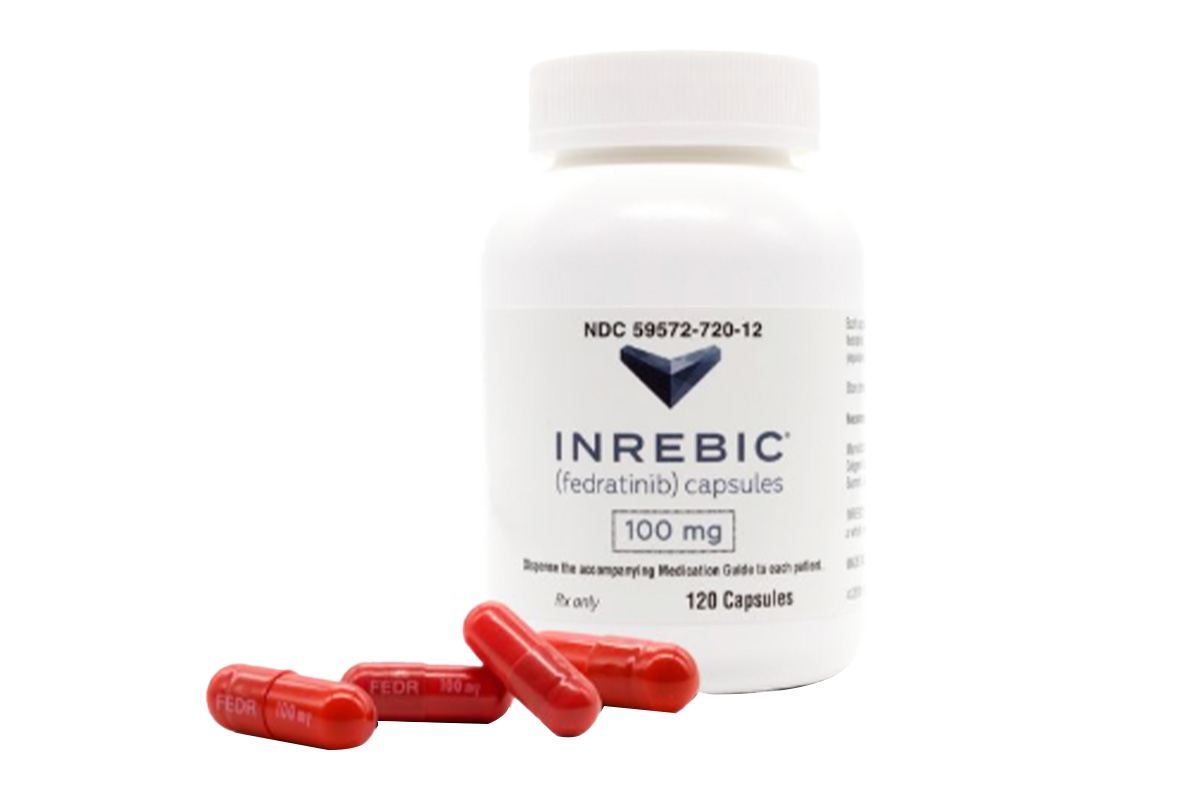



菲达替尼(fedratinib)
图片来源: 图片来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供参考。
菲达替尼(Fedratinib)是一种口服的小分子激酶抑制剂,由Celgene(新基医药)研发,2019年美国施贵宝公司完成对Celgene的收购。
菲达替尼上市进程于2019年取得突破性进展:8月首次获得美国FDA批准,成为近十年内FDA批准的首个骨髓纤维化新疗法;同年12月,该药又获得欧盟批准,随后在加拿大、瑞士等多个国家和地区陆续上市。

菲达替尼是一种口服激酶抑制剂,通过选择性抑制Janus相关激酶2(JAK2)和FMS样酪氨酸激酶3(FLT3)的活性发挥作用。JAK2的异常激活与骨髓增殖性肿瘤(MPNs,如骨髓纤维化和真性红细胞增多症)密切相关。菲达替尼通过阻断JAK2介导的信号转导和转录激活因子(STAT3/5)的磷酸化,抑制细胞增殖并诱导凋亡,从而改善脾肿大、贫血等症状。
药品称呼
通用名称:菲达替尼、Fedratinib
商品名称:Inrebic
适应靶点
JAK2、FLT3
适应症和适应人群
适应症
用于治疗中危-2或高危的原发性骨髓纤维化(MF)或继发性骨髓纤维化(包括真性红细胞增多症后骨髓纤维化或原发性血小板增多症后骨髓纤维化)的成人患者。
适应人群
成年患者(年龄≥18岁),基线血小板计数≥50×10⁹/L。
规格与性状
规格
100mg*120粒/瓶。
性状
红棕色不透明硬胶囊,胶囊上印有白色“FEDR100mg”字样。
主要成分
活性成分:菲达替尼二盐酸盐一水合物。
辅料:硅化微晶纤维素、硬脂酰富马酸钠等。
用法用量
1、推荐剂量
基线血小板计数≥50×10⁹/L的患者:400毫克口服,每日1次,随餐或空腹服用。
与强效CYP3A4抑制剂联用或严重肾功能不全(肌酐清除率15-29mL/min)时:减量至200毫克每日1次。
2、给药方法
整粒吞服,或对于吞咽困难或需鼻胃管给药者,可将胶囊内容物与约180mL Ensure Plus营养液混合后立即服用(2小时内)。鼻胃管给药后需用60mL水冲洗管道。
3、剂量调整
血液学毒性(如4级血小板减少或3级伴出血):暂停给药,恢复后减量100毫克/日。
非血液学毒性(如3级以上腹泻、肝酶升高):暂停给药,恢复后减量100毫克/日。
必需联用药物:所有患者需每日口服100毫克维生素B1(硫胺素)以预防脑病。
具体您可以阅读菲达替尼完整用法用量信息,建议在医生的指导下正确用药。推荐文章:菲达替尼(fedratinib)的用法用量。
不良反应
常见不良反应(≥20%)
腹泻、恶心、贫血、呕吐。
严重不良反应
脑病(包括韦尼克脑病):发生率1.3%,可能致命。
血液学毒性:3级贫血(34%)、3级血小板减少(12%)。
胃肠道毒性:3级腹泻(5%)、呕吐(3.1%)。
肝毒性:ALT/AST升高(43%/40%)。
胰腺酶升高:3级淀粉酶/脂肪酶升高(2%/10%)。
葡萄膜炎:发生率4%,多见于日本患者。
具体您可以阅读菲达替尼不良反应内容,建议在医生的指导下正确用药。推荐文章:菲达替尼(fedratinib)的不良反应。
注意事项
脑病风险:治疗前及治疗期间需监测维生素B1水平,缺乏者禁用。
血液监测:定期检测全血细胞计数、肝肾功能、淀粉酶/脂肪酶。
心血管风险:吸烟或有心血管病史者需警惕主要不良心血管事件(MACE)。
血栓及继发恶性肿瘤:尤其吸烟者风险增加。
葡萄膜炎:出现眼痛、视力下降需立即眼科评估。
特殊人群用药
【孕妇】目前尚无菲达替尼在孕妇中使用的临床数据,但动物实验显示,菲达替尼在低于人类推荐剂量时可能导致胚胎发育异常(如骨骼变异)。临床中仅在权衡治疗获益大于对胎儿潜在风险时方可使用,且需告知孕妇可能的胎儿风险。
【哺乳期女性】菲达替尼及其代谢产物是否进入人类母乳、对母乳喂养婴儿或乳汁分泌的影响均未知;基于药物潜在毒性,母乳喂养婴儿可能面临严重不良反应风险。因此建议哺乳期女性在接受菲达替尼治疗期间及末次剂量后至少1个月内避免母乳喂养,选择其他合适的婴儿喂养方式。
【具有生殖潜力的男性和女性】说明书中尚未明确相关信息。
【儿童使用】未开展菲达替尼在儿童患者中的安全性和有效性研究,无法确定儿童使用的风险;说明书明确其在儿童患者中的安全性和有效性尚未确立,不推荐儿童使用。
【老年人使用】老年患者(>65岁)与年轻患者在菲达替尼的安全性和有效性方面无显著差异,未发现老年患者特定的额外风险;因此无需调整起始剂量,治疗期间按常规监测不良反应即可。
【肾功能损害】轻度肾功能损害(CLcr60-89mL/min)对菲达替尼暴露量无显著影响;中度(CLcr30-59mL/min)和严重(CLcr15-29mL/min)肾功能损害患者暴露量依次升高,可能增加不良反应风险。临床指导为:严重肾功能损害患者需将剂量调整为200mg每日一次;轻中度损害患者无需调整起始剂量,但中度损害者需加强监测,出现不良反应按规定调整;终末期肾病(CLcr<15mL/min)患者用药数据未明确,需谨慎评估。
【肝功能损害】轻、中、重度肝功能损害(Child-PughA、B、C级)患者的菲达替尼药代动力学无临床意义改变,未发现相关额外风险。临床无需调整起始剂量,但治疗期间需定期监测肝功能(ALT、AST、胆红素),出现肝酶升高按规定处理。
禁忌症
尚不明确。
药物相互作用
其他药物对菲达替尼的影响
强效CYP3A4抑制剂(如酮康唑):合用会显著增加菲达替尼的药效,可能加重副作用。建议将菲达替尼剂量调整为200mg每日一次,并加强副作用监测。
强效与中效CYP3A4诱导剂(如利福平、依非韦伦):合用会显著降低菲达替尼的药效,可能导致治疗失败。因此应尽量避免与这类药物同时使用。
双重CYP3A4与CYP2C19抑制剂(如氟康唑):合用会增加菲达替尼的药效和副作用风险。合用期间需密切监测,若出现不良反应,需及时调整菲达替尼剂量。
菲达替尼对其他药物的影响
CYP3A4、CYP2C19或CYP2D6底物药物(如咪达唑仑、奥美拉唑、美托洛尔):菲达替尼会增强这些药物的效果,可能增加其副作用风险。合用时需监测这些药物的副作用,并根据需要调整它们的剂量。
OCT2与MATE1/2-K底物药物(如二甲双胍):菲达替尼会降低这些药物的排泄速度,使其在体内浓度升高,可能增加副作用风险(如二甲双胍相关的乳酸酸中毒)。合用时需密切监测,并根据需要调整它们的剂量。
药物过量
尚不明确。
药代动力学
吸收:达峰时间(Tₘₐₓ)约3小时,高脂餐可增加吸收。
分布:蛋白结合率≥92%,表观分布容积1770L。
代谢:主要通过CYP3A4、CYP2C19和FMO3代谢。
排泄:77%经粪便排出(23%原形),5%经尿液排出(3%原形)。
半衰期:有效半衰期41小时,终末半衰期约114小时。
贮存方法
30℃以下保存,避免阳光直射。
研发公司
Celgene Corporation(美国新基)
参考资料:FDA说明书更新于2025年5月12日,说明书网址:https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=212327
[ 免责声明 ] 本页面内容来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供持有医疗专业资质的人员用于医学药学研究参考,不构成任何治疗建议或药品推荐。所涉药品可能未在中国大陆获批上市,不适用于中国境内销售和使用。如需治疗,请咨询正规医疗机构。本站不提供药品销售或代购服务。
- 菲达替尼一次能囤几盒?多少钱?菲达替尼主要用于治疗患有中危-2或高危原发性或继发性(真性红细胞增多症或实质性血...[ 详情 ]推荐指数:5052025-04-27 17:45
- 菲达替尼有几种规格?多少钱?导读:菲达替尼是一种治疗骨髓纤维化的靶向药物,其在中国市场的可及性备受患者关注。...[ 详情 ]推荐指数:5012025-04-27 17:45
- 菲达替尼多少钱一盒?在哪里购买?菲达替尼是一种用于治疗骨髓纤维化的JAK抑制剂,其价格和购买渠道是患者关注的重点...[ 详情 ]推荐指数:5312025-04-27 17:42
- 菲达替尼有哪几个版本?分别多少钱?菲达替尼是一种用于治疗骨髓纤维化的靶向药物,目前在国际市场上有多个版本,价格因地...[ 详情 ]推荐指数:6192025-04-27 17:29
- 菲达替尼与芦可替尼:靶向治疗骨髓纤维化的双雄比较与差异解析导读:菲达替尼与芦可替尼都可用于治疗骨髓纤维化,但是两者在适用人群、作用靶点、副...[ 详情 ]推荐指数:12352025-01-21 18:12:52
- 2024年菲达替尼价格是多少?2024年菲达替尼规格为100mg×120粒,参考价格区间在52080~5500...[ 详情 ]推荐指数:11652025-01-21 04:02:51
- 骨髓纤维化靶向治疗药菲达替尼效果如何?骨髓纤维化靶向治疗药菲达替尼效果不错。菲达替尼(fedratinib)是继芦可替...[ 详情 ]推荐指数:12752025-01-20 18:39:36
- 菲达替尼(fedratinib)功效与作用,一个月剂量,费用?适应症菲达替尼(fedratinib)是一种Janus相关激酶2(JAK-2)和...[ 详情 ]推荐指数:11362025-01-21 10:51:23
- 2024年菲达替尼100mg×120粒装的售价多少钱一盒?您好,2024年菲达替尼100mg×120粒装的售价大概在52080$-5218...[ 详情 ]已帮助934人2024-04-11 13:44
- 菲达替尼和菲卓替尼一样吗?您好,菲达替尼和菲卓替尼是一样的。菲达替尼也叫菲卓替尼,商品名为Inrebic,...[ 详情 ]已帮助866人2024-04-11 13:40:19
- 菲达替尼有胃肠毒性吗?胃肠道毒性是接受菲达替尼(INREBIC)治疗的患者最常见的不良反应。在随机治疗...[ 详情 ]已帮助861人2024-03-04 16:00
- 菲达替尼的药物相互作用是什么?菲达替尼(INREBIC)的药物相互作用:1、CYP3A4强抑制剂:当患者同时使...[ 详情 ]已帮助896人2024-03-04 16:00
- 菲达替尼进入国家医保了吗?菲达替尼并未进入国家医保。截至2024年3月,菲达替尼并没有在中国上市,因此也就...[ 详情 ]已帮助869人2024-03-04 16:00
- 菲达替尼长期用药会导致肝损伤吗?菲达替尼长期用药会导致肝损伤。菲达替尼具有肝毒性,长期用药确实可导致肝损伤,药物...[ 详情 ]已帮助881人2024-01-18 09:16
- 菲达替尼2024年在中国上市了吗?没有,截至2024年1月,菲达替尼还没有在中国内地上市,但是已经在中国台湾上市。...[ 详情 ]已帮助892人2024-01-18 09:15
- 菲达替尼(fedratinib)引起不良反应如何调整剂量?菲达替尼(fedratinib)引起不良反应后需要根据不良反应的类型调整剂量,比...[ 详情 ]已帮助866人2024-01-18 09:11
- PM8002联合紫杉醇对比化疗二线治疗小细胞肺癌[适 应 症]小细胞肺癌[试验分期]Ⅱ期
- ES102联合特瑞普利单抗治疗晚期非小细胞肺癌[适 应 症]非小细胞肺癌[试验分期]Ⅱ期
- 比较Sigvotatug Vedotin与多西他赛治疗既往经治的非小细胞肺癌的研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- QL2107或Keytruda®联合化疗治疗转移性非鳞状非小细胞肺癌的临床研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- LM-299注射液单药或联合其它抗肿瘤药物治疗晚期实体瘤[适 应 症]实体瘤[试验分期]Ⅰ期
- SH-1028片对比安慰剂用于非小细胞肺癌辅助治疗[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
做您身边的贴心健康咨询管家

了解医药信息 关注临床动态
- 1宗格替尼(Hernexeo)的用药指南已帮助7人2026-02-11 17:41
- 2仑伐替尼(Lenvatinib)的作用功效,用药指南已帮助4人2026-02-11 17:41
- 3喜保宁(Sabril)的适应症已帮助4人2026-02-11 17:03
- 4盐酸司来吉兰(Eldepryl)的注意事项和药物相互作用已帮助7人2026-02-11 16:45
- 5盐酸司来吉兰(Eldepryl)是治疗什么疾病的已帮助7人2026-02-11 16:45
- 6盐酸司来吉兰(Eldepryl)的副作用如何缓解已帮助8人2026-02-11 15:06
- 7盐酸司来吉兰(Eldepryl)的用药注意事项已帮助7人2026-02-11 14:22
- 8盐酸司来吉兰(Eldepryl)的功效与作用已帮助8人2026-02-11 13:44
- 9美国FDA批准尼替西农(Nitisinone)用于治疗尿黑酸尿症患者已帮助9人2026-02-11 13:29
- 10卡那单抗(Canakinumab)的适应症,不良反应已帮助8人2026-02-10 17:43
- 11曲贝替定(Trabectedin)的作用功效及如何用药已帮助11人2026-02-10 17:17
- 12康奈非尼(Encorafenib)的适应症、注意事项已帮助10人2026-02-10 17:04
 组氨酸铜(Zycubo)确诊为门克斯病的儿科患者,年龄范围从出生至小于1...[ 详情 ]
组氨酸铜(Zycubo)确诊为门克斯病的儿科患者,年龄范围从出生至小于1...[ 详情 ] 羟钴胺注射液(Cyanokit)成人已知或疑似氰化物中毒的急诊治疗。儿科使用的安...[ 详情 ]
羟钴胺注射液(Cyanokit)成人已知或疑似氰化物中毒的急诊治疗。儿科使用的安...[ 详情 ] Jubereq(Denosumab-desu)预防多发性骨髓瘤患者以及实体瘤骨转移患者的骨骼相...[ 详情 ]
Jubereq(Denosumab-desu)预防多发性骨髓瘤患者以及实体瘤骨转移患者的骨骼相...[ 详情 ] 尼替西农(Nitisinone)经生化检测(如血浆或尿液中琥珀酰丙酮升高)确诊的...[ 详情 ]
尼替西农(Nitisinone)经生化检测(如血浆或尿液中琥珀酰丙酮升高)确诊的...[ 详情 ]



 医伴旅服务热线:
医伴旅服务热线:
































