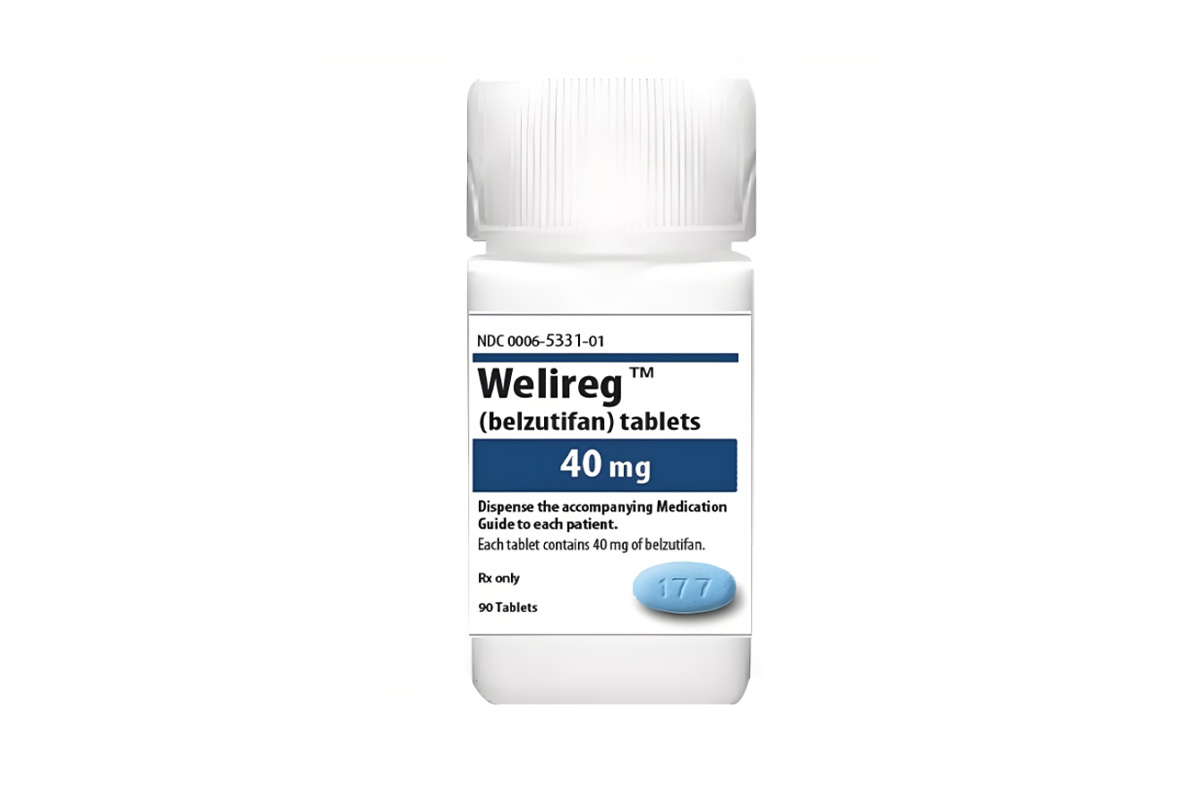



贝组替凡(Belzutifan)
图片来源: 图片来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供参考。
贝组替凡(Belzutifan)是由美国默沙东公司研发的一款新型小分子靶向药。该药物主要用于治疗与Von Hippel-Lindau(VHL)病相关的肾细胞癌、中枢神经系统血管母细胞瘤及胰腺神经内分泌肿瘤。
贝组替凡(Belzutifan)在2021年8月13日首次获得美国FDA批准上市,并在2024年11月进入中国市场。

贝组替凡(Belzutifan)是一种口服小分子缺氧诱导因子-2α(HIF-2α)抑制剂,通过靶向结合并抑制HIF-2α的活性,阻断其与HIF-1β的相互作用,从而减少下游促血管生成、细胞增殖及肿瘤生长相关基因的转录表达。
药品称呼
通用名称:贝组替凡、Belzutifan
商品名称:维利瑞、Welireg
适应靶点
缺氧诱导因子-2α(HIF-2α)
适应症和适应人群
1、VHL疾病相关肿瘤
需治疗的成人VHL患者,包括肾细胞癌(RCC)、中枢神经系统血管母细胞瘤(CNS)或胰腺神经内分泌肿瘤(pNET),且无需立即手术。
2、晚期肾细胞癌(RCC)
接受过PD-1/PD-L1抑制剂及VEGF-TKI治疗后进展的成人患者。
规格与性状
规格
40mg*90片/瓶。
性状
蓝色椭圆形片剂,一面刻有“177”,另一面为空白。
主要成分
活性成分:贝组替凡;
辅料:交联羧甲基纤维素钠、羟丙甲纤维素醋酸琥珀酸酯、硬脂酸镁、甘露醇等。
用法用量
1、推荐剂量
每次口服120mg,每日1次,随餐或空腹服用。
2、剂量调整
贫血(血红蛋白<8g/dL)
暂停用药至≥8g/dL,恢复后减量或永久停药。
低氧血症(静息血氧饱和度<88%)
暂停至缓解,恢复后减量或停药;危及生命者永久停药。
其他3级不良反应
暂停至缓解至≤2级后减量40mg;4级永久停药。
3、漏服处理
当日尽快补服,次日按原计划服药;呕吐后无需补服。
具体您可以阅读贝组替凡完整用法用量信息,建议在医生的指导下正确用药。推荐文章:贝组替凡(Belzutifan)的用法用量。
不良反应
1、VHL疾病患者
血红蛋白降低、疲劳、血肌酐升高、头痛、头晕、血糖升高、恶心。
严重反应:贫血、视力损害、高血压。
2、晚期RCC患者
血红蛋白降低、疲劳、肌酐升高、淋巴细胞减少、ALT升高、低钠、高钾。
严重反应:贫血、低氧血症、肺炎、出血。
建议您阅读贝组替凡的副作用完整内容,推荐文章:贝组替凡(Belzutifan)的副作用。
注意事项
胚胎-胎儿毒性
妊娠期禁用,治疗前需确认妊娠状态,育龄期患者需使用非激素避孕措施(激素避孕可能失效)。
贫血监测
治疗前及期间定期检测血红蛋白,必要时输血或调整剂量。
低氧血症监测
治疗前及期间监测血氧饱和度,出现症状(如呼吸困难)需立即处理。
肝肾功能不全
轻中度无需调整剂量;重度数据不足。
特殊人群用药
【孕妇】基于动物研究,贝组替凡可导致胎儿伤害。尚无孕妇使用贝组替凡的数据。告知孕妇和有生殖潜力的女性胎儿潜在风险。
【哺乳期女性】尚无贝组替凡或其代谢物在人乳中存在的数据,以及对母乳喂养儿童或乳汁产生的影响。由于可能对母乳喂养儿童造成严重不良反应,建议女性在治疗期间和最后一剂后1周不要母乳喂养。
【具有生殖潜力的男性和女性】在开始治疗前验证有生殖潜力女性的妊娠状态。有生殖潜力的女性在治疗期间和最后一剂后1周需使用有效的非激素避孕方法,因贝组替凡可能使某些激素避孕药失效。有生殖潜力女性伴侣的男性在治疗期间和最后一剂后1周需使用有效避孕方法。
【儿童使用】贝组替凡在12岁及以上儿童中治疗局部晚期、不可切除或转移性PPGL的安全性和有效性已确立。在12岁以下儿童中的安全性和有效性尚未确立。
【老年人使用】在晚期RCC患者中,老年患者与年轻患者在疗效上无总体差异,但老年患者的剂量中断和剂量减少发生率更高。
【肾功能损害】对于肾功能损害患者(包括终末期肾病),无需调整贝组替凡剂量。对于严重肾功能损害(根据MDRD估算的eGFR15-29mL/min)患者,应监测不良反应增加情况,并按推荐调整剂量。
【肝功能损害】对于轻度(总胆红素≤正常上限且天冬氨酸转氨酶>正常上限,或总胆红素>1至1.5×正常上限且任何天冬氨酸转氨酶)或中度(总胆红素>1.5至≤3×正常上限且任何天冬氨酸转氨酶或Child-PughB级)肝功能损害患者,无需调整贝组替凡剂量。尚未在严重肝功能损害(总胆红素>1.5×正常上限且任何天冬氨酸转氨酶)患者中进行研究。对于中度和严重肝功能损害患者,应监测不良反应增加情况,并按推荐调整剂量。
禁忌症
尚不明确。
药物相互作用
其他药物对贝组替凡的影响
UGT2B17或CYP2C19抑制剂:与UGT2B17或CYP2C19抑制剂合用会增加贝组替凡的暴露量,可能增加不良反应风险。应监测贫血和缺氧的体征和症状,并按推荐减少贝组替凡的剂量。
贝组替凡对其他药物的影响
CYP3A4底物:贝组替凡与CYP3A4底物合用会降低CYP3A底物的浓度,可能降低其疗效。应避免与敏感CYP3A4底物合用,因这些底物浓度的轻微降低可能导致治疗失败。若无法避免合用,应根据其说明书增加敏感CYP3A4底物的剂量。在UGT2B17和CYP2C19双重慢代谢者中,这种浓度降低可能更明显。
激素避孕药:贝组替凡与激素避孕药合用可能导致避孕失败或突破性出血增加,有生殖潜力的女性应使用非激素避孕方法。
药物过量
无特效解毒剂,需停药并支持治疗。超剂量(≥240mg)可能引发严重低氧血症或血小板减少。
药代动力学
吸收:达峰时间1-2小时,食物不影响生物利用度。
分布:血浆蛋白结合率45%,表观分布容积119L。
代谢:主要通过UGT2B17和CYP2C19代谢,少量经CYP3A4。
排泄:半衰期14小时,49.6%经尿、51.7%经粪便排出。
贮存方法
避光保存于20℃-25℃(允许15℃-30℃短期存放),药瓶内含干燥剂,请勿食用。
研发公司
美国默沙东
参考资料:FDA说明书更新于2025年5月,FDA说明书网址:https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=215383
[ 免责声明 ] 本页面内容来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供持有医疗专业资质的人员用于医学药学研究参考,不构成任何治疗建议或药品推荐。所涉药品可能未在中国大陆获批上市,不适用于中国境内销售和使用。如需治疗,请咨询正规医疗机构。本站不提供药品销售或代购服务。
- 贝组替凡的购买渠道贝组替凡用于需治疗的成人VHL患者,包括肾细胞癌(RCC)、中枢神经系统血管母细...[ 详情 ]推荐指数:5952025-04-25 17:30
- 贝组替凡一个疗程多少钱?贝组替凡主要用于治疗与VonHippel-Lindau(VHL)病相关的肾细胞癌...[ 详情 ]推荐指数:7682025-04-25 17:22
- 贝组替凡各版本价格一览贝组替凡(Belzutifan)是治疗VHL综合征相关肿瘤的创新靶向药物,其不同...[ 详情 ]推荐指数:10832025-04-25 17:22
- 贝组替凡2025年价格详情贝组替凡(Belzutifan)是治疗VHL综合征相关肿瘤的靶向药物,其2025...[ 详情 ]推荐指数:8132025-04-25 17:22
- 贝组替凡国内价格是多少贝组替凡(Belzutifan)是治疗希佩尔-林道(VHL)综合征相关肾细胞癌、...[ 详情 ]推荐指数:8622025-04-25 16:56
- 贝组替凡一个疗程多少钱贝组替凡(Belzutifan)是治疗VHL综合征相关肿瘤的新型靶向药物,比如肾...[ 详情 ]推荐指数:11892025-05-01 10:17
- 贝组替凡治疗肾癌的功效与作用及疗效导读:贝组替凡作为一种新型的靶向治疗药物,在肾细胞癌的治疗中展现出了显著的疗效和...[ 详情 ]推荐指数:14492025-01-21 18:13:10
- 贝组替凡治疗肾癌的副作用及价格?贝组替凡治疗肾癌的副作用有血红蛋白减少、疲劳、淋巴细胞减少、肌肉骨骼疼痛、钠减少...[ 详情 ]推荐指数:15022025-01-21 18:13:23
- 贝组替凡对胎儿有哪些危害?贝组替凡具有胚胎-胎儿毒性,在一项动物生殖研究中,在器官形成期对怀孕大鼠口服贝组...[ 详情 ]已帮助876人2024-04-19 13:25
- 贝组替凡需要多长时间才能发挥作用?贝组替凡可能需要4-6个月或更长时间才能发挥作用,才能开始缩小肿瘤体积。贝组替凡...[ 详情 ]已帮助882人2024-04-19 13:07
- 贝组替凡美国默沙东版2024年的购买方式?贝组替凡由默沙东生产,患者通常可以通过以下几种方式购买贝组替凡:1、药房购买:患...[ 详情 ]已帮助882人2024-03-13 11:40
- 贝组替凡在中国上市了吗?没有。贝组替凡截止到2024年3月13日还没有在中国大陆地区上市,国内的医院药房...[ 详情 ]已帮助899人2024-03-13 11:39
- 贝组替凡的特殊人群用药是怎样的?贝组替凡在特殊人群中的用药情况大致如下:1、妊娠患者:贝组替凡可能对胎儿造成损害...[ 详情 ]已帮助963人2024-03-13 11:37
- 贝组替凡治疗肾癌要服用多久?贝组替凡治疗肾癌要服用多久因人而异。贝组替凡治疗肾癌的服用时间因人而异,具体疗程...[ 详情 ]已帮助906人2024-03-13 11:32
- Belzutifan(贝组替凡)一瓶能吃几天?Belzutifan(贝组替凡)一瓶能吃30天。Belzutifan(贝组替凡)...[ 详情 ]已帮助895人2024-03-08 10:40
- 少吃一次贝组替凡需要补上吗?少吃一次贝组替凡需要补上。如果错过了一剂贝组替凡,可以在当天尽快服用,保证药物在...[ 详情 ]已帮助907人2024-03-08 10:28
- PM8002联合紫杉醇对比化疗二线治疗小细胞肺癌[适 应 症]小细胞肺癌[试验分期]Ⅱ期
- ES102联合特瑞普利单抗治疗晚期非小细胞肺癌[适 应 症]非小细胞肺癌[试验分期]Ⅱ期
- 比较Sigvotatug Vedotin与多西他赛治疗既往经治的非小细胞肺癌的研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- QL2107或Keytruda®联合化疗治疗转移性非鳞状非小细胞肺癌的临床研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- LM-299注射液单药或联合其它抗肿瘤药物治疗晚期实体瘤[适 应 症]实体瘤[试验分期]Ⅰ期
- SH-1028片对比安慰剂用于非小细胞肺癌辅助治疗[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
做您身边的贴心健康咨询管家

了解医药信息 关注临床动态
- 1奎扎替尼(quizartinib)用法用量已帮助4人2026-02-26 16:37:23
- 2奎扎替尼(quizartinib)的药代动力学已帮助3人2026-02-26 16:37:13
- 3依普利酮(Eplerenone)的用法用量已帮助3人2026-02-26 17:46
- 4黄体酮胶囊(Progesterone)的功效与作用已帮助3人2026-02-26 17:46
- 5硼替佐米(Velcade)国内能买到吗?在哪能买到?已帮助5人2026-02-26 17:28
- 6硼替佐米(Velcade)如何用药已帮助5人2026-02-26 17:07
- 7硼替佐米(Velcade)的用药指南已帮助5人2026-02-26 17:07
- 8硼替佐米(Velcade)怎么购买已帮助6人2026-02-26 16:37
- 92026年硼替佐米(Velcade)最新价格是多少钱一盒?已帮助4人2026-02-26 16:31
- 10硼替佐米(Velcade)的注意事项和药物相互作用已帮助7人2026-02-26 16:19
- 11硼替佐米(Velcade)是治疗什么疾病的已帮助8人2026-02-26 15:54
- 12硼替佐米(Velcade)的副作用如何缓解已帮助8人2026-02-26 15:26
 幽门螺旋杆菌根除治疗药(Vonosap Pack)适用于治疗对阿莫西林和克拉霉素敏感的幽门螺旋杆菌...[ 详情 ]
幽门螺旋杆菌根除治疗药(Vonosap Pack)适用于治疗对阿莫西林和克拉霉素敏感的幽门螺旋杆菌...[ 详情 ] 卡左双巴缓释片(Sinemet)适用于治疗原发性帕金森病、脑炎后帕金森综合征,以...[ 详情 ]
卡左双巴缓释片(Sinemet)适用于治疗原发性帕金森病、脑炎后帕金森综合征,以...[ 详情 ] 神经妥乐平片(Neurotropin)患有带状疱疹后神经痛、腰痛症、颈肩腕综合征、肩关...[ 详情 ]
神经妥乐平片(Neurotropin)患有带状疱疹后神经痛、腰痛症、颈肩腕综合征、肩关...[ 详情 ] 甲氧沙林软膏(Oxsoralen)诊断为寻常性白斑,且无相关禁忌症的成人和儿童患者...[ 详情 ]
甲氧沙林软膏(Oxsoralen)诊断为寻常性白斑,且无相关禁忌症的成人和儿童患者...[ 详情 ]



 医伴旅服务热线:
医伴旅服务热线:
































