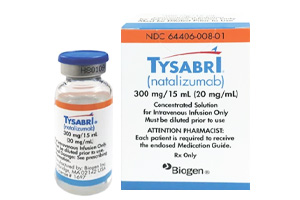
FDA批准Tyruko(natalizumab-sztn),作为Tysabri的生物类似药

2023年8月25日--全球仿制药和生物类似药领域的领导者山德士公司今日宣布,美国食品药品监督管理局(FDA)已批准其由PolpharmaBiologics公司开发的生物类似药Tyruko(natalizumab-sztn)。
Tyruko获准用于治疗参照药所涵盖的所有适应症,并且是首个也是目前唯一一个获得FDA批准的用于治疗复发型多发性硬化症(MS)的生物类似药。
山德士公司北美区总裁KerenHaruvi表示:"在美国近百万的多发性硬化症患者中,有数十万人经历疾病复发。Tyruko有潜力为这些患者扩展那他珠单抗治疗的可及性,通过市场竞争增加医疗储蓄并激发创新。"
Tyruko获准作为单药治疗,用于参照药Tysabri(那他珠单抗)所涵盖的所有复发型多发性硬化症适应症,包括临床孤立综合征(CIS)、复发缓解型多发性硬化症(RRMS)和活动性继发进展型疾病,以及成人克罗恩病。
美国国家多发性硬化症协会倡导与医疗可及性执行副总裁BariTalente表示:"获得负担得起的、高质量的医疗服务对于多发性硬化症患者过上最佳生活至关重要。Tyruko的批准,作为首个FDA批准的用于复发型多发性硬化症患者的生物类似疾病修饰治疗,是一个里程碑。生物类似药是重要的治疗选择,因为它们与其参照药没有临床意义上的差异。处方这些药物可以增加负担得起的药物的可及性,提高治疗依从性,并有助于控制医疗成本。"
FDA的批准是基于一个全面的数据包,包括分析学、功能学和临床数据。该批准附带包含安全警告的标签和一项风险评价和减灾策略(REMS)。
Tyruko具有与参照药相同的静脉注射(IV)剂型、给药途径、给药方案和包装形式。山德士致力于Tyruko患者安全的各个方面,该药上市后将通过山德士的REMS项目提供。
多发性硬化症是一种中枢神经系统的进行性慢性炎症和神经退行性疾病,可严重影响日常生活。2大多数多发性硬化症患者会经历新症状出现或复发(部分或完全改善)的时期,随后是疾病缓解期。
山德士于2019年与PolpharmaBiologics就Tyruko达成了全球商业化协议。根据该协议,PolpharmaBiologics将继续负责Tyruko活性成分的开发、生产和供应。通过一项独家全球许可,山德士拥有在所有市场商业化和分销该药物的权利。山德士致力于尽快将这一重要药物带给美国患者。
关于Tyruko(natalizumab-sztn)
Tyruko被开发用于高度类似于其参照药,后者是一种在复发型多发性硬化症(MS)治疗中已确立的、高效的抗α4整合素单克隆抗体疾病修饰治疗药物。Tyruko在美国被指定作为单药治疗用于复发型多发性硬化症,包括临床孤立综合征(CIS)、复发缓解型多发性硬化症(RRMS)和活动性继发进展型疾病,以及成人克罗恩病。它是首个也是目前唯一一个获得FDA批准的用于复发型多发性硬化症的生物类似药。
适应症
多发性硬化症(MS)
TYRUKO被指定作为单药治疗,用于成人复发型多发性硬化症的治疗,包括临床孤立综合征、复发缓解型疾病和活动性继发进展型疾病。那他珠单抗产品会增加进行性多灶性白质脑病(PML)的风险。因此,那他珠单抗仅可通过专门的风险评价和减灾策略(REMS)项目获得。在开始和继续TYRUKO治疗时,医生应考虑TYRUKO的预期获益是否足以抵消此风险。
克罗恩病(CD)
Tyruko被指定用于诱导和维持具有炎症证据的中度至重度活动性克罗恩病成人患者的临床应答和缓解,这些患者对常规CD疗法和TNF-α抑制剂反应不足或无法耐受。Tyruko不应与免疫抑制剂(例如,6-巯基嘌呤、硫唑嘌呤、环孢素或甲氨蝶呤)或TNF-α抑制剂联合使用。
禁忌症
患有或曾患有PML的患者。对那他珠单抗产品有过超敏反应的患者。
警告和注意事项
疱疹感染:已发生疱疹性脑炎和脑膜炎感染的危及生命和致死病例。发生急性视网膜坏死的患者曾出现失明。如果发生这些感染,应停用Tyruko并进行适当治疗。肝毒性:已发生显著的肝损伤,包括需要移植的肝衰竭。对有肝损伤证据的患者停用Tyruko。
超敏反应:已发生严重的超敏反应(例如,过敏性休克)。如果发生此类反应,应永久停用Tyruko。
免疫抑制/感染:那他珠单抗产品可能增加某些感染的风险。因使用Tyruko会增加感染风险,应监测患者是否发生感染。
血小板减少症:那他珠单抗产品可能导致血小板减少症。监测患者是否有出血异常。对患有血小板减少症的患者停用Tyruko。
不良反应
在MS研究中,使用那他珠单抗最常见的不良反应(发生率≥10%)包括头痛、疲劳、关节痛、尿路感染、下呼吸道感染、胃肠炎、阴道炎、抑郁、肢体疼痛、腹部不适、非特异性腹泻和皮疹。在CD研究中,最常见的不良反应(发生率≥10%)包括头痛、疲劳、上呼吸道感染和恶心。
在特定人群中的使用
妊娠期:可能造成胎儿损害。
参考资料: FDA说明书更新于2025年3月,FDA说明书网址:https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=125104
[ 免责声明 ] 本页面内容来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供持有医疗专业资质的人员用于医学药学研究参考,不构成任何治疗建议或药品推荐。所涉药品可能未在中国大陆获批上市,不适用于中国境内销售和使用。如需治疗,请咨询正规医疗机构。本站不提供药品销售或代购服务。
免费询价

- 那他珠单抗(Natalizumab)如何用药那他珠单抗(Natalizumab)是一种重组人源化单克隆抗体,用药需严格遵循指...[ 详情 ]推荐指数:3882025-10-02 17:43
- 那他珠单抗(Natalizumab)的用法用量那他珠单抗(Natalizumab)是一种整合素受体拮抗剂,通过抑制α4-整合素...[ 详情 ]推荐指数:3312025-10-02 17:43
- 那他珠单抗(Natalizumab)怎么购买那他珠单抗(Natalizumab)是一种高风险的免疫调节药物,其使用需严格遵循...[ 详情 ]推荐指数:3042025-10-02 17:43
- 2025年那他珠单抗(Natalizumab)最新价格是多少钱一盒?那他珠单抗(Natalizumab)的药品价格为境外公开资料,不用于国内销售。2...[ 详情 ]推荐指数:3602025-10-02 17:43
- 那他珠单抗(Natalizumab)国内价格是多少那他珠单抗(Natalizumab)是一种α4-整合素抑制剂,它能有效抑制免疫细...[ 详情 ]推荐指数:3982025-10-02 17:43
- 那他珠单抗(Natalizumab)的注意事项和药物相互作用?那他珠单抗(Natalizumab)最初由Biogen(与Elan合作)研发,需...[ 详情 ]推荐指数:3312025-10-02 17:43
- 那他珠单抗(Natalizumab)是治疗什么疾病的?那他珠单抗(Natalizumab)是一种用于治疗特定自身免疫性疾病的生物制剂,...[ 详情 ]推荐指数:3712025-10-02 17:43
- 那他珠单抗(Natalizumab)的副作用如何缓解?那他珠单抗(Natalizumab)通过抑制免疫细胞迁移来发挥作用,虽然其疗效显...[ 详情 ]推荐指数:3522025-10-02 17:43
- PM8002联合紫杉醇对比化疗二线治疗小细胞肺癌[适 应 症]小细胞肺癌[试验分期]Ⅱ期
- ES102联合特瑞普利单抗治疗晚期非小细胞肺癌[适 应 症]非小细胞肺癌[试验分期]Ⅱ期
- 比较Sigvotatug Vedotin与多西他赛治疗既往经治的非小细胞肺癌的研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- QL2107或Keytruda®联合化疗治疗转移性非鳞状非小细胞肺癌的临床研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- LM-299注射液单药或联合其它抗肿瘤药物治疗晚期实体瘤[适 应 症]实体瘤[试验分期]Ⅰ期
- SH-1028片对比安慰剂用于非小细胞肺癌辅助治疗[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
做您身边的贴心健康咨询管家

了解医药信息 关注临床动态
- 1阿伐曲泊帕(Doptelet)用药常见问题解答已帮助3人2026-02-13 17:29
- 2超级希爱力双效片(ExtraSuperTadarise)的适应症及用法用量已帮助4人2026-02-13 16:32:12
- 3氘可来昔替尼(Deucravacitinib)的药代动力学已帮助5人2026-02-13 16:33:12
- 4硼替佐米(Velcade)的副作用和不良反应已帮助3人2026-02-13 16:29:51
- 5硼替佐米(Velcade)的用法用量:用药指南,剂量调整,特殊人群用药已帮助3人2026-02-13 16:29:36
- 6硼替佐米(Velcade)中文说明书已帮助3人2026-02-13 16:29:21
- 7硼替佐米(Velcade)的详细说明书:作用与功效,用法用量,副作用,注意事项等已帮助4人2026-02-13 16:29:08
- 8Kygevvi(Doxecitine and doxirbitmine)怎么购买已帮助3人2026-02-13 15:44
- 9FDA批准注射用硼替佐米(Velcade)用于治疗复发性及难治性多发性骨髓瘤已帮助3人2026-02-13 15:44
- 10FDA扩大注射用硼替佐米(Velcade)对于多发性骨髓瘤患者的标签说明已帮助6人2026-02-13 14:55
- 11FDA批准注射用硼替佐米(Velcade)用于初治多发性骨髓瘤患者已帮助5人2026-02-13 14:06
- 12FDA批准将持续性总生存获益数据添加至注射用硼替佐米(Velcade)用于初治多发性骨髓瘤患者的药品标签已帮助4人2026-02-13 13:38:04
 日本维生素c(Cinal)适用于消耗性疾病、妊娠期、哺乳期等状态下,因膳食...[ 详情 ]
日本维生素c(Cinal)适用于消耗性疾病、妊娠期、哺乳期等状态下,因膳食...[ 详情 ] 雌二醇片(Julina)适用于缓解更年期障碍及卵巢缺失引发的相关症状,包...[ 详情 ]
雌二醇片(Julina)适用于缓解更年期障碍及卵巢缺失引发的相关症状,包...[ 详情 ] 黄体酮胶囊(Progesterone)具有完整子宫的女性;处于更年期或卵巢功能缺失状态...[ 详情 ]
黄体酮胶囊(Progesterone)具有完整子宫的女性;处于更年期或卵巢功能缺失状态...[ 详情 ] A型肉毒毒素(Dysport)适用于成人颈肌张力障碍、65岁以下成人中重度眉间...[ 详情 ]
A型肉毒毒素(Dysport)适用于成人颈肌张力障碍、65岁以下成人中重度眉间...[ 详情 ]