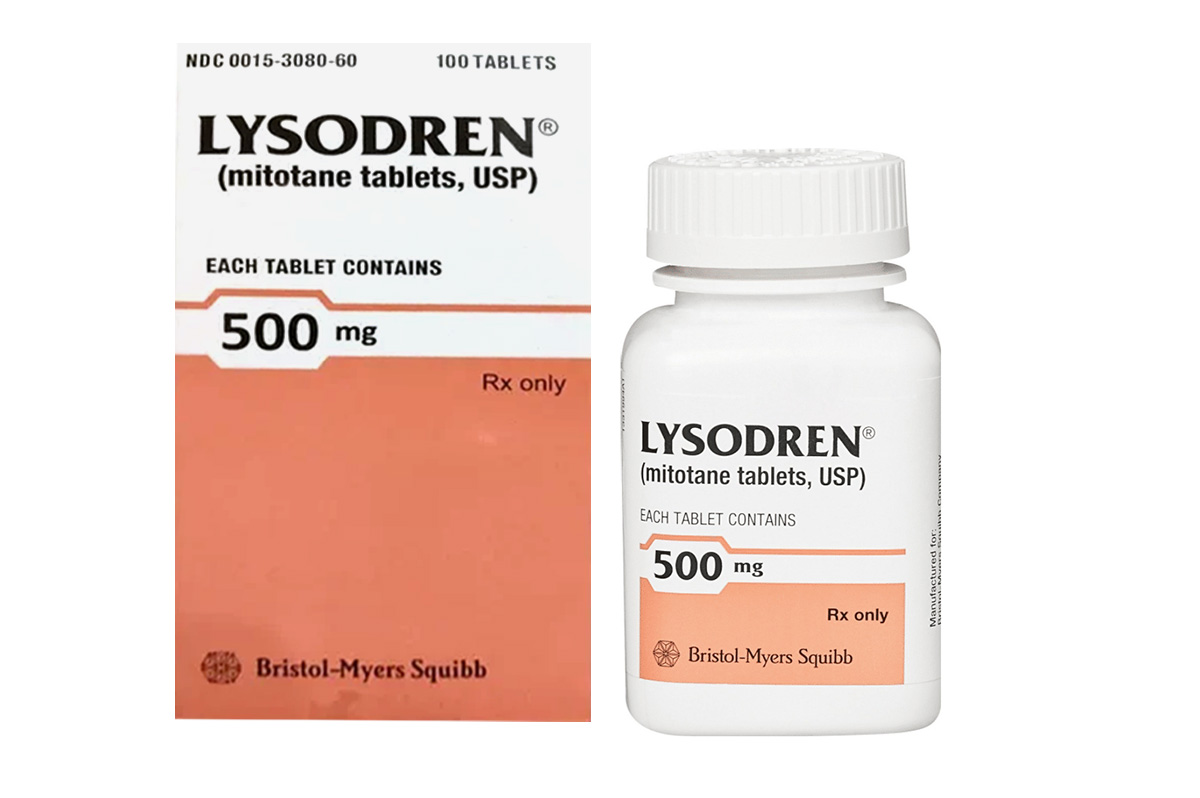



米托坦(Mitotane)
图片来源: 图片来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供参考。
米托坦(Mitotane)是一种口服肾上腺细胞毒性药物,于1970年首次获得美国食品药品监督管理局(FDA)批准上市。
米托坦自上市以来,虽作用机制尚未完全明确,但凭借独特的治疗靶点,成为晚期ACC治疗的核心选择之一,且需严格遵循个体化剂量调整及特殊人群用药指导。

米托坦是一种口服肾上腺细胞毒性剂,其作用机制尚未完全明确,主要通过调节类固醇的外周代谢并直接抑制肾上腺皮质发挥药理作用。临床应用中需严格监测血浆药物浓度及不良反应以保障用药安全。
药品称呼
通用名称:米托坦、Mitotane
商品名称:Lysodren
适应靶点
尚未明确。
适应症和适应人群
适应症
用于治疗不可手术切除、功能性或非功能性的肾上腺皮质癌(ACC)。
适应人群
确诊为肾上腺皮质癌,且肿瘤无法通过手术切除的成年患者(儿童患者有效性尚未确立)。
规格与性状
规格
片剂,每片500mg。
性状
本品为白色、圆形、双凸的有刻痕片剂,一侧带有二分线,另一侧压印“BL”字样及“L1”标识,无臭、无味,略具芳香气味。
主要成分
活性成分:米托坦(Mitotane)。
辅料:微晶纤维素、聚乙二醇3350、二氧化硅、淀粉。
用法用量
用药前推荐评估与检测
开始使用米托坦前,绝经前女性需完成盆腔超声检查,所有患者均需进行肝功能检测及全血细胞计数,为用药安全提供基线数据。
用药注意事项
米托坦属于危险药物,护理人员在接触片剂时应佩戴一次性手套,避免直接接触压碎或破损的片剂;若皮肤不慎接触破损片剂,需立即用肥皂水彻底清洗污染部位。
推荐剂量与给药方式
推荐初始剂量:每日口服2000mg至6000mg,分3-4次给药,需与食物同服,且服药时间与进餐的相对规律需保持一致,与高脂肪食物同服可增强药物吸收。
剂量调整与浓度监测:用药期间需监测米托坦血浆浓度,根据患者耐受性及临床反应逐步调整剂量,目标血浆浓度为14-20mg/升,该目标浓度通常需3-5个月达到。开始治疗后及每次剂量调整后,建议每2周监测一次血浆浓度,达标后可改为每月监测一次。若血浆浓度超过20mg/升但未出现毒性反应,可考虑将剂量减少50%-75%;停药后,由于药物半衰期较长,仍需每2个月监测一次血浆浓度,直至药物浓度无法检测。
特殊人群剂量监测:米托坦具有亲脂性,易在脂肪组织中蓄积,即使维持固定剂量,血浆浓度也可能突然升高,因此超重患者及近期体重减轻的患者需密切监测血浆浓度;即使暂时停药,脂肪组织仍可能持续释放药物,需继续监测血浆浓度。
给药注意事项:片剂需整片吞服,不可压碎、咀嚼或分割;请勿服用出现变质迹象的片剂;若患者漏服一次剂量,无需补服,按原计划服用下一次剂量即可;若服药后发生呕吐,也无需补服,下次剂量正常服用。
不良反应的剂量调整
不良反应严重程度依据美国国家癌症研究所常见不良反应事件评价标准(NCICTCAE)5.0版分级,具体剂量调整如下:
肾上腺危象与肾上腺功能不全(所有级别)
在休克、创伤、感染或肾上腺功能不全期间暂停用药,直至症状恢复至1级或基线水平,之后根据严重程度降低剂量恢复用药或永久停药。
中枢神经系统毒性
2级:检测米托坦血浆浓度,若浓度低于14mg/升,每日剂量减少1000mg;若浓度在14-20mg/升(治疗窗内),每日剂量减少1500mg;若浓度超过20mg/升,暂停用药直至症状恢复至1级或基线水平,症状缓解后7-10天,以降低后的剂量恢复用药。
3级或4级:暂停用药直至症状恢复至1级或基线水平,症状缓解后7-10天,根据严重程度降低剂量恢复用药或永久停药。
胃肠道毒性(3级或4级):检测米托坦血浆浓度,若浓度低于14mg/升,每日剂量减少1000mg;若浓度在治疗窗内,每日剂量减少1500mg;若浓度超过20mg/升,暂停用药直至症状恢复至1级或基线水平,之后根据严重程度降低剂量恢复用药或永久停药。
肝毒性(3级或4级):暂停用药直至肝功能恢复至1级或基线水平,之后根据严重程度降低剂量恢复用药或永久停药。
血液学毒性
2级:暂停用药直至血液学指标恢复至1级或基线水平,之后以原剂量恢复用药。
3级或4级:暂停用药直至血液学指标恢复至1级或基线水平,之后根据严重程度降低剂量恢复用药或永久停药。
其他不良反应
2级:暂停用药直至症状恢复至1级或基线水平,之后以原剂量恢复用药。
3级或4级:暂停用药直至症状恢复至1级或基线水平,之后根据严重程度降低剂量恢复用药或永久停药。
具体您可以阅读米托坦完整用法用量信息,建议在医生的指导下正确用药。推荐文章:米托坦(Mitotane)的用法用量。
不良反应
常见不良反应
主要包括厌食、上腹部不适、恶心、呕吐、腹泻、抑郁、头晕、眩晕、皮疹、高胆固醇血症、高甘油三酯血症、甲状腺功能减退、男性血游离睾酮降低等。
具体您可以阅读米托坦完整副作用信息,建议在医生的指导下正确用药。推荐文章:米托坦(Mitotane)的副作用。
注意事项
肾上腺功能不全与肾上腺危象:米托坦可能导致或加重肾上腺功能不全,需监测并适时进行激素替代治疗,并在休克、创伤、感染等情况下调整剂量或停药。
中枢神经系统毒性:米托坦可能引起中枢神经系统毒性如镇静、嗜睡等,需定期评估并根据血药浓度及症状严重程度调整用药策略。
绝经前女性卵巢大囊肿:米托坦可致绝经前女性出现多发性双侧卵巢囊肿,需通过影像学检查监控,并根据症状严重程度调整治疗方案。
肝毒性:米托坦使用过程中可能出现肝损伤甚至肝衰竭,需定期监测肝功能并根据情况调整治疗。
血液系统毒性:米托坦可引发白细胞减少、贫血等血液系统问题,需监测全血细胞计数并据此调整剂量。
出血时间延长:米托坦可能影响血小板功能导致出血时间延长,手术或牙科操作前应评估出血风险并调整用药。
激素结合蛋白影响:米托坦增加血浆激素结合蛋白水平,解释激素检测结果时需考虑此因素,且可能导致男性乳房发育。
胚胎-胎儿毒性:米托坦对胎儿有害,孕妇应知晓潜在风险,有生殖潜力的女性需采取有效非激素避孕措施。
特殊人群用药
【孕妇使用】米托坦可能对胎儿造成危害,包括早产和早期妊娠丢失的风险,因此不建议孕妇使用。
【哺乳期女性】应避免在治疗期间及停药后至血浆药物浓度无法检测前母乳喂养,因为米托坦可分泌至人乳中并对婴儿造成严重不良反应。
【具有生殖潜力的女性】应在用药前确认妊娠状态,并于治疗期间及停药后使用非激素避孕措施,因米托坦可能导致激素避孕失效;男性则需在医生指导下评估用药风险。
【儿童使用】米托坦的有效性和安全性尚未确立,可能存在神经心理发育影响及其他雌激素样效应,需谨慎使用并密切监测。
【老年人使用】米托坦时,由于生理功能下降及合并症的可能性,剂量选择需谨慎,通常从低剂量开始并密切监测耐受性和血浆药物浓度。
【肾功能损害者】对于肾功能损害患者,尤其是严重损害者,不推荐使用米托坦,轻至中度损害者需频繁监测血浆药物浓度并调整剂量以降低不良反应风险。
【肝功能损害患者】特别是严重损害者,不推荐使用米托坦,轻至中度损害者同样需要频繁监测血浆药物浓度,并根据结果调整剂量。
禁忌症
无明确禁忌症。
药物相互作用
(一)其他药物对米托坦的影响
螺内酯可能阻断米托坦的作用,不建议两者合用。
(二)米托坦对其他药物的影响
细胞色素P4503A(CYP3A)底物:米托坦是强效CYP3A诱导剂,合用可能降低CYP3A底物的血浆浓度,导致其疗效下降。对于血药浓度轻微变化即可能导致严重治疗失败的CYP3A底物,不建议合用;若无法避免合用,需根据底物的药品说明书调整剂量。
激素避孕药:米托坦可能导致激素避孕失效,不建议两者合用。
华法林:米托坦可能诱导华法林代谢,降低其血浆浓度和抗凝疗效。不建议两者合用;若无法避免合用,需更频繁地监测国际标准化比值(INR),并根据华法林的药品说明书调整剂量。
药物过量
症状:米托坦过量(血浆浓度超过20mg/升)可引发中枢神经系统毒性,表现为镇静、嗜睡、眩晕、肌肉无力、步态障碍等症状。
处理原则:根据毒性症状临床评估后暂停用药;由于药物具有亲脂性且半衰期长,血浆浓度可能需要数周才能下降,且药物不易通过透析清除,需增加血浆药物浓度监测频率,密切观察患者症状并给予支持治疗。
药代动力学
吸收:口服后约40%的剂量被吸收,与高脂肪食物同服可增强吸收(不同制剂的相关数据支持该结论),食物对吸收的具体影响尚未完全明确。
分布:米托坦可分布于全身多数组织,主要蓄积于脂肪组织中。
代谢:米托坦可经肝脏和肝外途径代谢,主要代谢产物为1,1-(邻、对二氯二苯基)乙酸(o,p’-DDA),为主要循环代谢产物。
排泄:尿液和胆汁中未检测到原形药物,约10%的给药剂量以水溶性代谢产物形式经尿液排泄,1%-17%的代谢产物经胆汁排泄。
贮存方法
本品需密封,在25℃条件下保存,允许在15℃-30℃范围内波动。本品为危险药物,需按照相关特殊处理和处置程序进行储存和管理,避免儿童接触。
生产公司
百时美施贵宝
参考资料:FDA网站更新于2024年10月28日,说明书网址:https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=016885
[ 免责声明 ] 本页面内容来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供持有医疗专业资质的人员用于医学药学研究参考,不构成任何治疗建议或药品推荐。所涉药品可能未在中国大陆获批上市,不适用于中国境内销售和使用。如需治疗,请咨询正规医疗机构。本站不提供药品销售或代购服务。
- 进口解腺瘤片2021年最新价格大概多少?解腺瘤片正品哪里买?解腺瘤片(米托坦)是目前治疗肾上腺皮质癌(ACC)最常用的、反应率最高的药物,解...[ 详情 ]推荐指数:7952025-01-21 00:58:04
- 【药物特性】解腺瘤片适应症有哪些?解腺瘤片治疗效果如何?解腺瘤片(Lysodren)是治疗肾上腺皮质癌的特效药物。解腺瘤片(Lysodr...[ 详情 ]推荐指数:7242025-01-21 00:57:52
- 解腺瘤片是什么药?解腺瘤片治什么的?效果如何?解腺瘤片是什么药?解腺瘤片治什么的?效果如何?肾上腺皮质癌又称ACC,是临床上比...[ 详情 ]推荐指数:6702025-01-21 12:56:52
- 解腺瘤片治疗给药时注意什么1970年解腺瘤片获得美国食品药品监督管理局(FDA)批准用于治疗肾上腺皮质癌,...[ 详情 ]推荐指数:8492025-01-21 08:39:48
- 孤儿药:解腺瘤片不良反应和警告注意事项解腺瘤片主要用于无法手术的、功能性和非功能性肾上腺皮质癌、肾上腺皮质增生以及肿瘤...[ 详情 ]推荐指数:12732025-01-21 16:48:41
- 肾上腺皮质癌孤儿药解腺瘤片的效果肾上腺皮质癌(ACC)是罕见的内分泌恶性肿瘤,预后较差。解腺瘤片是目前唯一被批准...[ 详情 ]推荐指数:9492025-01-21 08:39:45
- 肾上腺癌唯一的克星解腺瘤片解腺瘤片结构与杀虫药DDT和DDD相似,可使肾上腺皮质萎缩和坏死。给予解腺瘤片后...[ 详情 ]推荐指数:8112025-01-21 05:06:56
- 得了肾上腺皮质癌怎么办?不同疾病分期采用不同治疗策略!发生于肾上腺皮质的恶性肿瘤称为肾上腺皮质癌。12岁以下儿童较多见,仅少数发生在成...[ 详情 ]推荐指数:13082025-01-20 22:30:31
- PM8002联合紫杉醇对比化疗二线治疗小细胞肺癌[适 应 症]小细胞肺癌[试验分期]Ⅱ期
- ES102联合特瑞普利单抗治疗晚期非小细胞肺癌[适 应 症]非小细胞肺癌[试验分期]Ⅱ期
- 比较Sigvotatug Vedotin与多西他赛治疗既往经治的非小细胞肺癌的研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- QL2107或Keytruda®联合化疗治疗转移性非鳞状非小细胞肺癌的临床研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- LM-299注射液单药或联合其它抗肿瘤药物治疗晚期实体瘤[适 应 症]实体瘤[试验分期]Ⅰ期
- SH-1028片对比安慰剂用于非小细胞肺癌辅助治疗[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
做您身边的贴心健康咨询管家

了解医药信息 关注临床动态
- 1斯贝利单抗(Voyxact)的副作用和不良反应已帮助6人2026-02-03 15:21:13
- 2司美替尼(selumetinib)的作用功效及副作用已帮助8人2026-02-03 16:58
- 3芦可替尼乳膏(Opzelura)的适应症与用法用量已帮助14人2026-02-03 16:10:33
- 4西罗莫司(Sirolimus)的适应症已帮助7人2026-02-03 16:10
- 5伏硫西汀片(Trintellix)是治疗什么疾病的已帮助8人2026-02-03 15:36
- 6斯贝利单抗(Voyxact)的用法用量:用药指南,剂量调整,特殊人群用药已帮助11人2026-02-03 15:20:54
- 7斯贝利单抗(Voyxact)中文说明书已帮助8人2026-02-03 15:20:33
- 8斯贝利单抗(Voyxact)的详细说明书:作用与功效,用法用量,副作用,注意事项等已帮助10人2026-02-03 15:20:08
- 9伏硫西汀片(Trintellix)的副作用如何缓解已帮助10人2026-02-03 14:23
- 10伏硫西汀片(Trintellix)的用药注意事项已帮助8人2026-02-03 14:04
- 11斯贝利单抗(Voyxact)获美国FDA授予治疗免疫球蛋白A肾病的突破性疗法认定已帮助10人2026-02-03 13:31
- 12大冢制药宣布美国FDA接受并优先审评斯贝利单抗(Voyxact)用于治疗免疫球蛋白A肾病(IgAN)的生物制品许可申请已帮助10人2026-02-03 13:31
 盐酸曲马多(Tramal)用于非阿片类镇痛药无效或不耐受的中重度疼痛(包括...[ 详情 ]
盐酸曲马多(Tramal)用于非阿片类镇痛药无效或不耐受的中重度疼痛(包括...[ 详情 ] 氢化可的松复合痔疮软膏(Posterisan)适用于缓解痔疮、肛裂、肛周湿疹/皮炎、轻度直肠炎...[ 详情 ]
氢化可的松复合痔疮软膏(Posterisan)适用于缓解痔疮、肛裂、肛周湿疹/皮炎、轻度直肠炎...[ 详情 ] 盐酸氨溴索缓释胶囊(Mucosolvan)适用于需要进行黏液溶解治疗的急性和慢性支气管肺部...[ 详情 ]
盐酸氨溴索缓释胶囊(Mucosolvan)适用于需要进行黏液溶解治疗的急性和慢性支气管肺部...[ 详情 ] 缬沙坦片(Diovan)用于降低成人及儿童高血压、减轻心力衰竭患者的住院...[ 详情 ]
缬沙坦片(Diovan)用于降低成人及儿童高血压、减轻心力衰竭患者的住院...[ 详情 ]



 医伴旅服务热线:
医伴旅服务热线:
































