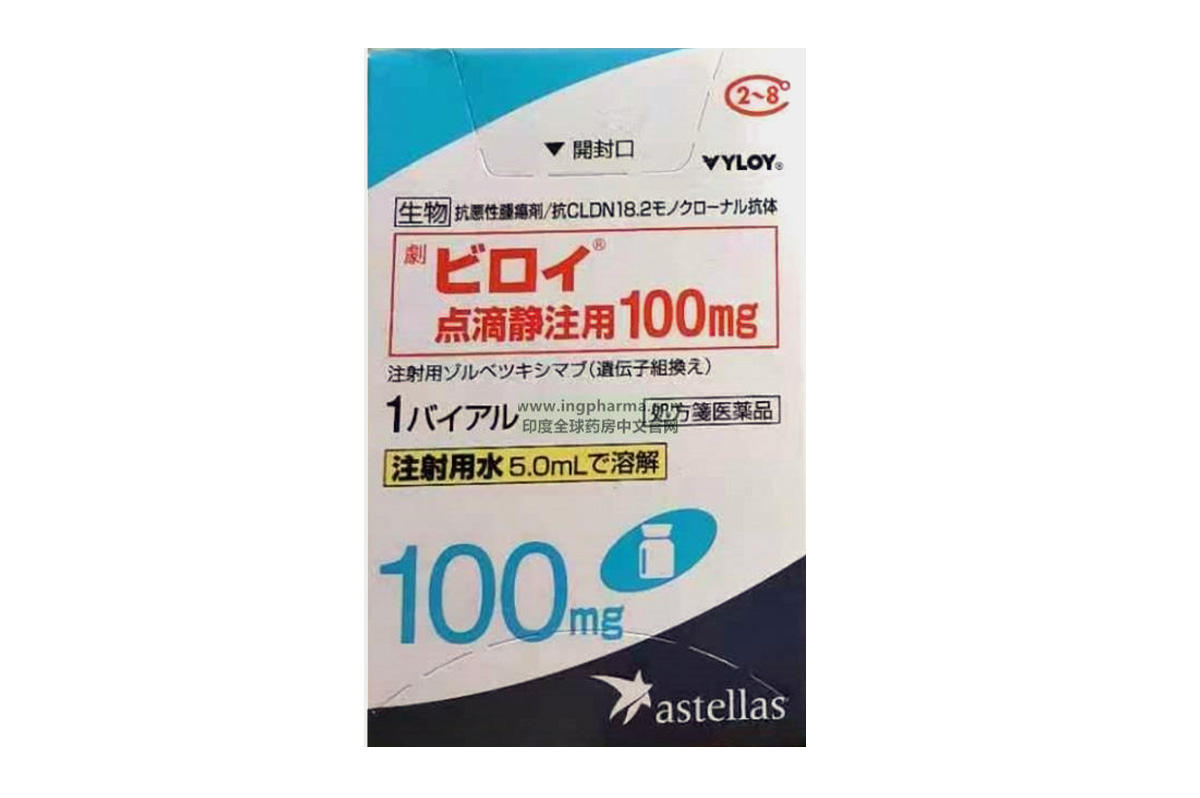



佐妥昔单抗(Zolbetuximab)
图片来源: 图片来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供参考。
佐妥昔单抗(Zolbetuximab)是一种靶向Claudin18.2(CLDN18.2)的单克隆抗体。该药主要用于治疗CLDN18.2阳性、HER2阴性的局部晚期不可切除或转移性胃癌及胃食管交界处(GEJ)腺癌。
佐妥昔单抗最早由Ganymed Pharmaceuticals开发,后被安斯泰来收购。2024年3月,该药在日本获批,成为全球首款CLDN18.2靶向药物。此后,陆续在英国、欧盟、韩国和美国获批。2024年12月,中国国家药品监督管理局也批准了其上市申请。

临床研究显示,佐妥昔单抗联合含氟尿嘧啶和铂类的化疗方案,可显著延长局部晚期不可切除或转移性HER2阴性胃癌/胃食管交界腺癌(CLDN18.2阳性)患者的无进展生存期(PFS)和总生存期(OS),适用于一线治疗。
药品称呼
通用名称:佐妥昔单抗、Zolbetuximab
商品名称:Vyloy、威络益
适应靶点
Claudin18.2(CLDN18.2):一种跨膜蛋白,在胃癌等实体瘤中高表达,参与细胞间紧密连接的形成。靶向CLDN18.2可特异性杀伤肿瘤细胞。
适应症和适应人群
适应症
联合含氟尿嘧啶和铂类的化疗方案,一线治疗局部晚期不可切除或转移性HER2阴性胃癌或胃食管交界腺癌成人患者,需符合以下条件:
1、肿瘤CLDN18.2阳性(≥75%肿瘤细胞中膜染色强度为中度至强,经FDA批准的VENTANA CLDN18检测确认);
2、无完全或部分胃出口梗阻综合征,无中枢神经系统转移史。
适用人群
1、成年患者(年龄≥18岁);
2、HER2阴性且CLDN18.2阳性患者。
规格与性状
规格:100mg*1瓶/盒;
性状:白色至类白色冻干粉末,复溶后为无色至淡黄色澄清或微乳光液体。
主要成分
活性成分:佐妥昔单抗
用法用量
1、推荐方案
首剂800mg/m²,静脉输注;
2、后续剂量
每3周一次,600mg/m²,或每2周一次,400mg/m²;持续治疗至疾病进展或不可耐受毒性。
具体您可以阅读佐妥昔单抗完整用法用量信息,建议在医生的指导下正确用药。推荐文章:佐妥昔单抗(Zolbetuximab)的用法用量。
不良反应
最常报告的副作用
恶心、呕吐、疲劳、食欲下降、腹泻、周围感觉神经病变、腹痛、便秘、体重下降、超敏反应、发热。
最常报告的实验室检查异常
中性粒细胞计数降低、白细胞计数降低、白蛋白降低、肌酐升高、血红蛋白降低、血糖升高、淋巴细胞计数降低、天门冬氨酸转氨酶(AST)升高、血小板减少、碱性磷酸酶升高、丙氨酸转氨酶(ALT)升高、血糖降低、钠降低、磷酸盐升高、钾降低、镁降低。
最常见导致停药的副作用
恶心和呕吐。
佐妥昔单抗存在一定的副作用,建议出现不适后及时咨询医生。推荐文章:佐妥昔单抗(Zolbetuximab)的不良反应。
注意事项
过敏与输注反应
输注期间及结束后至少监测2小时;出现荨麻疹、喘息、喉头水肿等症状立即停药。
恶心呕吐管理
输注前常规止吐预处理;≥3级呕吐需暂停治疗。
血液学监测
定期检查血常规、肝肾功能及电解质。
特殊人群用药
【孕妇】尚无孕妇使用佐妥昔单抗的相关数据以明确药物相关风险。动物研究中,妊娠小鼠静脉给予佐妥昔单抗,未观察到胚胎-胎儿毒性。佐妥昔单抗可通过胎盘屏障。仅在获益大于潜在风险时,方可给予孕妇佐妥昔单抗。
【哺乳期女性】尚无佐妥昔单抗在人乳中存在的数据,也无其对母乳喂养婴儿或乳汁生成的影响数据。由于抗体可能在人乳中排泄,且可能对母乳喂养婴儿产生潜在不良反应,建议哺乳期女性在佐妥昔单抗治疗期间及最后一剂后8个月内不要母乳喂养。
【具有生殖潜力的男性和女性】佐妥昔单抗与氟嘧啶或含铂类化疗联合使用。有关妊娠检测、避孕和不育的信息,请参考氟嘧啶和含铂类化疗药物的完整处方信息。
【儿童使用】佐妥昔单抗在儿科患者中的安全性和有效性尚未确立。
【老年人使用】佐妥昔单抗在老年患者与较年轻患者在安全性或有效性方面未观察到总体差异。
【肾功能损害】在轻至中度肾功能损害患者中,未观察到佐妥昔单抗清除率有临床意义的影响。严重肾功能损害患者的影响尚不明确。
【肝功能损害】在轻度肝功能损害患者中,未观察到佐妥昔单抗清除率有临床意义的影响。中至重度肝功能损害患者的影响尚不明确。
禁忌症
尚不明确。
药物相互作用
化疗药物:与含铂或氟尿嘧啶方案联用需注意毒性叠加;
免疫抑制剂:可能影响疗效,需谨慎联用;
其他:无明确相互作用报告。
药物过量
尚不明确。若发生过量,需对症支持治疗。
药代动力学
吸收:静脉输注后达峰时间2小时,剂量范围内呈线性药代;
分布:稳态分布容积14.0L,蛋白结合率未明确;
代谢:通过蛋白水解降解为小肽和氨基酸;
消除:半衰期41天,清除率0.013L/h;
特殊人群:年龄、性别、轻中度肝肾功能不全无需调整剂量。
贮存方法
未开封:原包装2-8℃冷藏,禁止冷冻;
复溶后:室温(15-30℃)保存≤5小时,稀释液室温保存≤6小时或冷藏(2-8℃)≤16小时;
输注液:需使用含0.2μm过滤器的输液管路。
研发公司
安斯泰来制药(Astellas)
参考资料:FDA说明书更新于2025年6月,FDA说明书网址:https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=761365
[ 免责声明 ] 本页面内容来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供持有医疗专业资质的人员用于医学药学研究参考,不构成任何治疗建议或药品推荐。所涉药品可能未在中国大陆获批上市,不适用于中国境内销售和使用。如需治疗,请咨询正规医疗机构。本站不提供药品销售或代购服务。
- 佐妥昔单抗(zolbetuximab)中文说明书:适应症、用法用量、不良反应、注意事项、特殊人群用药佐妥昔单抗(zolbetuximab)是日本安斯泰来制药(AstellasPha...[ 详情 ]推荐指数:11672025-08-08 14:10:28
- 佐妥昔单抗(zolbetuximab)详细说明书佐妥昔单抗(zolbetuximab)是由日本安斯泰来制药公司研发的一款靶向克劳...[ 详情 ]推荐指数:15132025-08-07 15:36:26
- 佐妥昔单抗(zolbetuximab)的不良反应和副作用佐妥昔单抗(zolbetuximab)的不良反应具有个体差异化,患者在使用佐妥昔...[ 详情 ]推荐指数:10122025-08-07 17:14:38
- 佐妥昔单抗(zolbetuximab)用法用量:推荐剂量,不良反应剂量调整佐妥昔单抗(zolbetuximab)为注射剂,它的剂量是需要严格把控,根据患者...[ 详情 ]推荐指数:11152025-08-07 17:09:27
- FDA批准佐妥昔单抗(zolbetuximab)用于治疗晚期胃癌和胃食管交界处腺癌佐妥昔单抗(zolbetuximab)是一种克劳丁18.2定向溶细胞抗体由日本安...[ 详情 ]推荐指数:10812025-08-07 15:13:13
- 佐妥昔单抗的用法用量佐妥昔单抗是全球首个靶向CLDN18.2的单克隆抗体药物,为晚期复发性胃癌患者提...[ 详情 ]推荐指数:8642025-07-01 17:44
- 佐妥昔单抗副作用与注意事项佐妥昔单抗是一种靶向CLDN18.2的单克隆抗体药物,主要用于治疗CLDN18....[ 详情 ]推荐指数:10032025-07-01 17:44
- 佐妥昔单抗的购买渠道有哪些?佐妥昔单抗的商品名叫做威络益,是一种针对CLDN18.2阳性的局部晚期或转移性胃...[ 详情 ]推荐指数:10902025-04-10 16:33
- 佐妥昔单抗用法用量指南佐妥昔单抗是一种与含氟嘧啶和含铂化疗联合使用的靶向药物,需根据体表面积计算剂量,...[ 详情 ]已帮助809人2025-10-13 11:19
- 佐妥昔单抗一盒能用多久?佐妥昔单抗的药品有效期和单盒使用时长需结合其储存条件及临床给药方案综合判断,未开...[ 详情 ]已帮助872人2025-10-13 11:19
- 佐妥昔单抗常见不良反应有哪些?佐妥昔单抗常见不良反应可分为可能自行缓解的轻度反应和需立即就医的严重反应两类,主...[ 详情 ]已帮助840人2025-10-13 11:19
- 佐妥昔单抗的功效与作用全面解析佐妥昔单抗是一种靶向CLDN18.2的单克隆抗体,通过与化疗联用治疗特定胃癌患者...[ 详情 ]已帮助836人2025-09-09 10:33
- 佐妥昔单抗的用药注意事项有哪些佐妥昔单抗用药需重点关注超敏反应与消化道副作用,特殊人群需调整用药方案,联合用药...[ 详情 ]已帮助838人2025-09-09 10:31
- 佐妥昔单抗一次能囤几盒?佐妥昔单抗是治疗CLDN18.2阳性胃癌的靶向药物,其储存和购买需遵循严格的医疗...[ 详情 ]已帮助812人2025-07-02 11:25
- 佐妥昔单抗(Zolbetuximab)在哪里买比较靠谱?佐妥昔单抗(Zolbetuximab)在医院、药店、医疗服务机构等地方购买比较靠...[ 详情 ]已帮助905人2024-09-30 13:30
- 佐妥昔单抗(Zolbetuximab)孕妇可以用吗?佐妥昔单抗孕妇一般不可以用,除非治疗效果明显大于潜在风险。在人类中,IgG是唯一...[ 详情 ]已帮助923人2024-09-30 13:30
- PM8002联合紫杉醇对比化疗二线治疗小细胞肺癌[适 应 症]小细胞肺癌[试验分期]Ⅱ期
- ES102联合特瑞普利单抗治疗晚期非小细胞肺癌[适 应 症]非小细胞肺癌[试验分期]Ⅱ期
- 比较Sigvotatug Vedotin与多西他赛治疗既往经治的非小细胞肺癌的研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- QL2107或Keytruda®联合化疗治疗转移性非鳞状非小细胞肺癌的临床研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- LM-299注射液单药或联合其它抗肿瘤药物治疗晚期实体瘤[适 应 症]实体瘤[试验分期]Ⅰ期
- SH-1028片对比安慰剂用于非小细胞肺癌辅助治疗[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
做您身边的贴心健康咨询管家

了解医药信息 关注临床动态
- 1厄达替尼(Erdafitinib)的副作用与药物相互作用已帮助5人2026-03-05 17:51
- 2伏立康唑(Vfend)用药说明已帮助5人2026-03-05 17:48
- 3卡左双巴缓释片(Sinemet)的用药注意事项已帮助5人2026-03-05 17:46
- 4左甲状腺素钠片(Euthyrox)国内能买到吗?已帮助4人2026-03-05 16:31:26
- 5左甲状腺素钠片(Euthyrox)如何购买已帮助7人2026-03-05 16:31:13
- 62026年左甲状腺素钠片(Euthyrox)最新价格是多少钱一盒?已帮助7人2026-03-05 16:31:00
- 7左甲状腺素钠片(Euthyrox)多少钱一盒?已帮助6人2026-03-05 16:30:30
- 8恩他卡朋(Entacapone)的副作用和不良反应已帮助9人2026-03-05 16:29:55
- 9恩他卡朋(Entacapone)的用法用量:用药指南,剂量调整,特殊人群用药已帮助9人2026-03-05 16:29:42
- 10恩他卡朋(Entacapone)中文说明书已帮助5人2026-03-05 16:29:31
- 11恩他卡朋(Entacapone)的详细说明书:作用与功效,用法用量,副作用,注意事项等已帮助7人2026-03-05 16:29:12
- 12吡托布鲁替尼(Pirtobrutinib)国内能买到吗?在哪能买到?已帮助8人2026-03-05 16:21
 盐酸小檗碱(Phelloberin)适用于因急性胃肠炎、慢性肠炎、消化不良、肠道菌群...[ 详情 ]
盐酸小檗碱(Phelloberin)适用于因急性胃肠炎、慢性肠炎、消化不良、肠道菌群...[ 详情 ] 利珠赛迷你眼药水(Ryjusea)通常适用于5岁至15岁,近视进展较快(如每年进展...[ 详情 ]
利珠赛迷你眼药水(Ryjusea)通常适用于5岁至15岁,近视进展较快(如每年进展...[ 详情 ] 醋酸亮丙瑞林(Eligard)适用于需进行雄激素剥夺治疗的成年男性前列腺癌患者...[ 详情 ]
醋酸亮丙瑞林(Eligard)适用于需进行雄激素剥夺治疗的成年男性前列腺癌患者...[ 详情 ] 碘卵磷脂片(Jolethin)用于治疗碘缺乏引起的甲状腺疾病、眼底血管及渗出性...[ 详情 ]
碘卵磷脂片(Jolethin)用于治疗碘缺乏引起的甲状腺疾病、眼底血管及渗出性...[ 详情 ]



 医伴旅服务热线:
医伴旅服务热线:
































