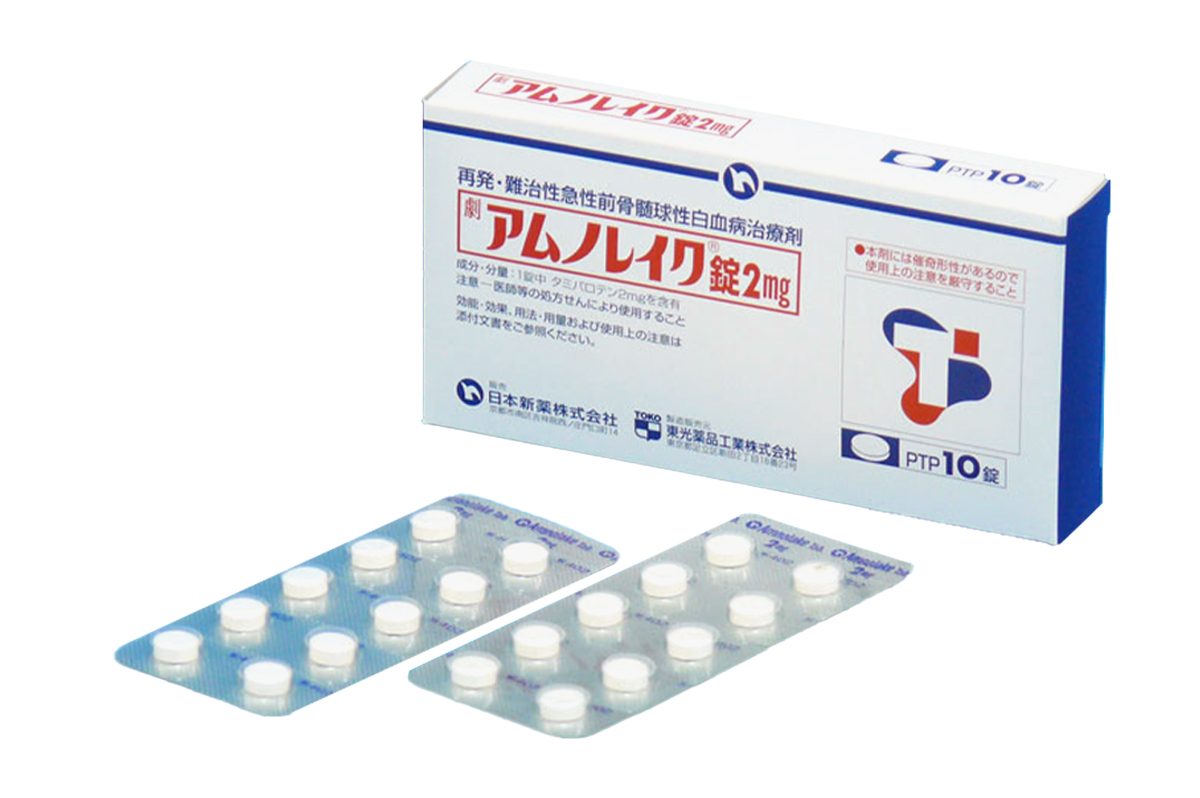



他米巴罗汀(Amnolake)
图片来源: 图片来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供参考。
2005年,他米巴罗汀在日本获批上市。由于他米巴罗汀具有明确的致畸性和较高的不良反应发生率,用药前必须详细向患者及其法定代理人说明可能出现的副作用,例如分化综合征、感染、白细胞增多等及其风险,并取得充分的知情同意。
在治疗过程中定期评估患者的血液、肝肾功能以及心电图变化,及早发现和处理可能出现的不良反应;对于高风险患者,如合并DIC、骨质疏松等情况,应加强监控并做好紧急应对准。

他米巴罗汀(Tamibarotene)是一种选择性视黄酸受体α(RARα)激动剂类小分子抗肿瘤药物,通过特异性激活RARα受体,诱导急性早幼粒细胞白血病(APL)细胞分化并促进其凋亡。
药品称呼
通用名称:他米巴罗汀、tamibarotene
商品名称:Amnolake
其他名称:アムノレイク
适应靶点
视黄酸受体α(RARα)
规格和性状
规格:2mg*10片/盒;
性状:外观为白色片剂;尺寸约为直径7mm、厚度3mm,单片质量约150mg。
适应症和适应人群
适应症:复发或难治性急性早幼粒细胞白血病(APL)。
适应人群:经标准治疗后复发或无效的APL成人患者。
主要成分
他米巴罗汀
用法用量
缓解诱导疗法
每日6mg/m²,分两次于早、晚餐后口服,持续用药至骨髓缓解。
疗程限制
总疗程不得超过8周。
剂量限制
每日最大剂量不超过12mg/m²,超量使用的安全性及有效性尚未明确。
未建立长期维持治疗的推荐方案。
不良反应
1、常见严重不良反应
分化综合征(表现为发热、呼吸困难、胸腔积液、低氧血症等),可能致死,需立即停药并予糖皮质激素冲击治疗。
间质性肺病、多器官功能衰竭、肝肾功能损伤。
2、其他不良反应
低血压、肺浸润、心包积液、消化道出血。
3、特殊风险
具有致畸性,孕妇禁用。
注意事项
1.分化综合征监测
2.维生素A过量风险
3.脂质代谢监测
4.肝功能监测
5.凝血功能监测
特殊人群用药
1.孕妇
孕妇或可能怀孕的女性禁止使用。已有数据显示,本药品在0.3mg/kg/day时可导致胎儿死亡率增加及多种先天性异常(如唇裂、面裂、眼部及骨骼异常),在0.1mg/kg/day时则可能增加流产和胎儿异常风险。
2.哺乳期女性
哺乳期妇女应避免使用本药品。动物实验显示药物可通过乳汁转移,存在潜在风险。
3.具有生殖潜力的男性和女性
女性:仅在评估治疗益处明显大于风险,且无其他替代治疗方案时,方可使用;必须严格执行避孕措施——给药前至少1个月、给药期间及停药后2年内应采取有效避孕措施。此外,给药应在月经周期的第2或第3天启动,并在给药前两周内进行妊娠检测,给药期间每月进行一次检测。
男性:在治疗期间及停药后6个月内应采取避孕措施;动物实验提示可能出现精子生成异常,因此在用药时需评估对伴侣的潜在影响。
4.儿童使用
儿童用药尚未在充分的临床试验中确立。长期使用类似药物时曾报告颅内压增高,故儿童使用时风险与益处尚需进一步评估。
5.老年人使用
老年患者因生理功能减退,药物代谢及排泄可能较慢,且本药品与血浆蛋白结合率高,可能导致游离药物浓度增高,从而增加不良反应风险。老年人用药时应注意剂量调整,并定期监测血药浓度及肝、肾功能变化。
6.肾功能损害
有报道显示,类似药物在肾功能不全患者中可能引起严重肾损害。对于肾功能受损的患者,使用本药品时应密切观察肾功能指标,并在必要时调整剂量或考虑替代方案。
7.肝功能损害
类似药物(如异维A酸)在肝功能障碍患者中可能加重肝损害,因此对于肝功能不全的患者,本药品的使用须十分谨慎,需定期监测肝功能,并视具体情况调整用药或停药。
禁忌症
1.绝对禁忌
妊娠或可能妊娠的女性。
对本品成分过敏者。
正在使用维生素A制剂或维生素A过量患者。
2.相对禁忌
末梢血中“芽球及前骨髓球”计数>1000/mm³者需先进行化疗降低至安全范围。
药物相互作用
1.禁止合用
不得与维甲酸制剂(如异维A酸)合用,因两者均可能引起类似维甲酸过量的副作用,合用可能加重不良反应。
2.合用注意
CYP3A4诱导剂:例如圣约翰草及其含有食品,可能加速本药品代谢,降低血药浓度,减弱疗效;
CYP3A4抑制剂:例如部分抗真菌药、某些抗生素及拮抗剂,可能抑制本药品代谢,导致血药浓度升高,从而增加不良反应风险;
制酸剂:包括H2受体拮抗剂和抗酸药,因提高胃内pH可能增加本药品溶解度和吸收;
其他:与类似药物(如特瑞他诺)合用时可能降低本药品的蛋白结合率,使有效浓度升高;
抗纤溶药:如氨甲环酸等,因合用可能增加血栓形成风险;
抗凝血药:部分抗凝血药合用时可能影响凝血功能,增加血栓风险。
药代动力学
尚不明确。
贮存方法
本药品包装为铝箔包装(PTP),开封后应避湿、防光保存,置于室温条件下。
生产厂家
日本新药株式会社,日本东光药品工业株式会社。
参考资料:日本药监局说明书更新于2022年10月,说明书网址:https://www.info.pmda.go.jp/go/pack/4291014F1021_1_14/?view=frame&style=XML&lang=ja
[ 免责声明 ] 本页面内容来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供持有医疗专业资质的人员用于医学药学研究参考,不构成任何治疗建议或药品推荐。所涉药品可能未在中国大陆获批上市,不适用于中国境内销售和使用。如需治疗,请咨询正规医疗机构。本站不提供药品销售或代购服务。
- 他米巴罗汀的用法用量他米巴罗汀是一种第三代选择性维甲酸受体激动剂,主要用于治疗复发或难治性急性早幼粒...[ 详情 ]推荐指数:3412025-08-12 11:10
- 他米巴罗汀的适应症他米巴罗汀是一种第三代选择性维甲酸受体(RAR)激动剂,由日本新药株式会社研发,...[ 详情 ]推荐指数:3642025-08-12 10:44
- 他米巴罗汀的用药指南他米巴罗汀是一种第三代选择性维甲酸受体激动剂,主要用于治疗复发或难治性急性早幼粒...[ 详情 ]推荐指数:3642025-08-12 10:44
- 他米巴罗汀说明书,医保,价格,疗效,副作用他米巴罗汀是一种由日本新药株式会社研发的第三代选择性维甲酸受体(RAR)激动剂,...[ 详情 ]推荐指数:3002025-08-11 17:32
- 他米巴罗汀的副作用与注意事项他米巴罗汀是一种第三代选择性维甲酸受体(RAR)激动剂,由日本新药株式会社研发,...[ 详情 ]推荐指数:3202025-08-13 15:56:23
- 他米巴罗汀的副作用如何缓解他米巴罗汀作为治疗复发或难治性急性早幼粒细胞白血病(APL)的第三代选择性维甲酸...[ 详情 ]推荐指数:2992025-08-13 15:56:33
- 他米巴罗汀的购买渠道有哪些?他米巴罗汀是治疗急性早幼粒细胞白血病的重要靶向药物,其购买渠道的选择直接影响治疗...[ 详情 ]推荐指数:4052025-05-07 11:10:14
- 2025年他米巴罗汀最新价格是多少钱一盒?他米巴罗汀相较于传统全反式维甲酸(ATRA)具有更高的靶向性和效力,可有效克服A...[ 详情 ]推荐指数:5042025-05-07 16:25
- PM8002联合紫杉醇对比化疗二线治疗小细胞肺癌[适 应 症]小细胞肺癌[试验分期]Ⅱ期
- ES102联合特瑞普利单抗治疗晚期非小细胞肺癌[适 应 症]非小细胞肺癌[试验分期]Ⅱ期
- 比较Sigvotatug Vedotin与多西他赛治疗既往经治的非小细胞肺癌的研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- QL2107或Keytruda®联合化疗治疗转移性非鳞状非小细胞肺癌的临床研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- LM-299注射液单药或联合其它抗肿瘤药物治疗晚期实体瘤[适 应 症]实体瘤[试验分期]Ⅰ期
- SH-1028片对比安慰剂用于非小细胞肺癌辅助治疗[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
做您身边的贴心健康咨询管家

了解医药信息 关注临床动态
- 1瑞维美尼(Revuforj)的适应症与注意事项已帮助6人2026-01-28 17:46
- 2替比培南酯颗粒(Tebipenem)的副作用与注意事项已帮助4人2026-01-28 17:46
- 3盐酸普罗帕酮(Rythmol)的适应症与用法用量已帮助2人2026-01-28 17:46
- 4布美他尼(Enbumyst)的用药注意事项已帮助5人2026-01-28 17:31:24
- 5布美他尼(Enbumyst)的功效与作用已帮助5人2026-01-28 17:10
- 6多西环素(Vibramycin)国内能买到吗?在哪能买到?已帮助5人2026-01-28 16:57
- 7多西环素(Vibramycin)如何用药已帮助7人2026-01-28 16:26
- 8多西环素(Vibramycin)的用药指南已帮助7人2026-01-28 16:14
- 9多西环素(Vibramycin)怎么购买已帮助7人2026-01-28 16:14
- 102026年多西环素(Vibramycin)最新价格是多少钱一盒?已帮助8人2026-01-28 16:00
- 11多西环素(Vibramycin)的注意事项和药物相互作用已帮助9人2026-01-28 15:25:36
- 12多西环素(Vibramycin)是治疗什么疾病的已帮助6人2026-01-28 15:06
 西洛他唑(Pletaal)适用于确诊为慢性动脉闭塞症或非心源性脑梗塞的成人...[ 详情 ]
西洛他唑(Pletaal)适用于确诊为慢性动脉闭塞症或非心源性脑梗塞的成人...[ 详情 ] 精氨酸配合颗粒(L-Arginine)先天性尿素循环异常症以及赖氨酸尿性蛋白不耐受症(...[ 详情 ]
精氨酸配合颗粒(L-Arginine)先天性尿素循环异常症以及赖氨酸尿性蛋白不耐受症(...[ 详情 ] Vascepa(Icosapent ethyl)作为饮食辅助疗法,用于降低甘油三酯水平严重升高(...[ 详情 ]
Vascepa(Icosapent ethyl)作为饮食辅助疗法,用于降低甘油三酯水平严重升高(...[ 详情 ] 伏硫西汀片(Trintellix)通常适用于成人抑郁症患者。[ 详情 ]
伏硫西汀片(Trintellix)通常适用于成人抑郁症患者。[ 详情 ]



 医伴旅服务热线:
医伴旅服务热线:
































