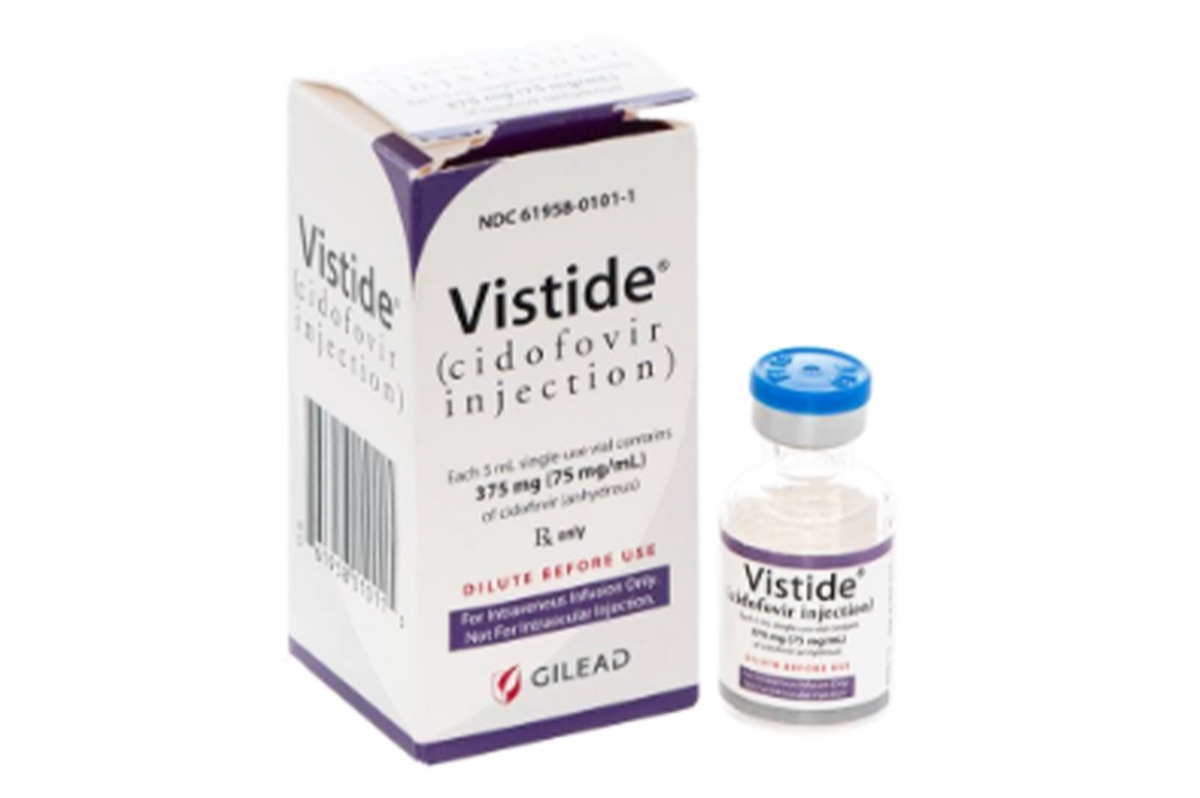



西多福韦(Cidofovir)
图片来源: 图片来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供参考。
西多福韦是由美国吉利德公司研发生产的一种广谱抗病毒药物,对多种病毒都有抑制或杀灭作用。1996年6月26日,西多福韦获得美国食品药品监督管理局(FDA)的上市批准。随后,欧洲药品管理局(EMA)、澳大利亚药品管理局(TGA)批准了西多福韦的上市。
在国外上市后,西多福韦曾多次被报道用于应对特殊病毒感染。不仅应用于免疫功能受损人群,还在部分新发传染病研究中被探索使用,这使其一直保持较高关注度。

西多福韦是一种核苷类似物抗病毒药物,通过选择性抑制病毒DNA聚合酶,抑制巨细胞病毒(CMV)的复制。西多福韦主要用于治疗艾滋病(AIDS)患者并发的CMV视网膜炎,具有强效抗CMV活性,但需注意其显著的肾毒性风险,需严格在专业医疗监督下使用。
药品称呼
通用名称:西多福韦、Cidofovir
商品名称:Vistide
适应靶点
病毒DNA聚合酶(尤其针对CMV及其他疱疹病毒)。
适应症和适应人群
适应症:适用于艾滋病(AIDS)患者并发巨细胞病毒(CMV)视网膜炎的治疗。
适应人群:成人艾滋病患者,且肾功能正常(血清肌酐≤1.5mg/dL,肌酐清除率>55mL/min,尿蛋白<100mg/dL)。
规格与性状
规格:75mg/ml*375mg/瓶。
性状:无色透明溶液,pH值调节至7.4,无防腐剂。
主要成分
西多福韦(Cidofovir)。
用法用量
1.诱导治疗
推荐剂量:5mg/kg体重,静脉输注1小时,每周1次,连续2周。
适用条件:血清肌酐≤1.5mg/dL,肌酐清除率>55mL/min,尿蛋白<100mg/dL。
2.维持治疗
推荐剂量:5mg/kg体重,静脉输注1小时,每2周1次。
3.剂量调整
肾功能变化:
若血清肌酐升高0.3–0.4mg/dL,维持剂量从5mg/kg降至3mg/kg。
若血清肌酐升高≥0.5mg/dL或出现≥3+蛋白尿,立即停药。
基线肾功能不全:
禁忌使用(血清肌酐>1.5mg/dL,肌酐清除率≤55mL/min,尿蛋白≥100mg/dL)。
4.丙磺舒(Probenecid)用法
每次西多福韦输注前3小时口服2g,输注结束后2小时和8小时各口服1g(总4g)。
建议餐后服用或合用止吐药以减少恶心呕吐。
5.水化方案
每次输注前1–2小时内静脉输注至少1L0.9%生理盐水,可酌情追加第2L。
6.配制与给药
抽取所需体积西多福韦,加入100mL0.9%生理盐水中,静脉输注1小时。
配制后24小时内使用,避免冷冻。
不可与其他药物或补充剂混合输注。
具体您可以阅读西多福韦完整用法用量信息,建议在医生的指导下正确用药。推荐文章:西多福韦的用法用量。
不良反应
常见(>15%):蛋白尿、恶心/呕吐、发热、中性粒细胞减少、乏力、头痛、皮疹、感染、脱发、腹泻、肌酐升高、贫血、厌食、呼吸困难、寒战、咳嗽加重、口腔念珠菌病。
严重:肾毒性(需透析或致死)、中性粒细胞减少、眼压降低、前葡萄膜炎/虹膜炎、代谢性酸中毒(伴Fanconi综合征)。
其他:肝功能障碍、胰腺炎、恶性肿瘤风险(动物实验显示致癌性)。
具体您可以阅读西多福韦副作用信息,建议在医生的指导下正确用药。推荐文章:西多福韦的副作用。
注意事项
肾毒性:每次给药前48小时内监测血清肌酐和尿蛋白。
中性粒细胞减少:定期监测中性粒细胞计数。
眼压降低:定期监测眼压和视力。
代谢性酸中毒:监测血清碳酸氢盐,注意伴发的肝功能障碍或胰腺炎。
葡萄膜炎/虹膜炎:可局部使用皮质类固醇或睫状肌麻痹剂。
药物配制与处理:因具有致突变性,需在生物安全柜中操作,穿戴防护装备。
特殊人群用药
【孕妇】妊娠分级C:动物实验显示胚胎毒性,无人类对照研究。仅在潜在获益大于风险时使用。
【哺乳期女性】不建议哺乳。西多福韦可能经乳汁排泄,且存在致癌风险。
【具有生殖潜力的男性和女性】男性治疗期间及停药后3个月内使用屏障避孕。女性治疗期间及停药后1个月内使用有效避孕。
【儿童使用】安全性和有效性未确立。仅在对获益大于风险(长期致癌性和生殖毒性)时考虑使用。
【老年人使用】无专门研究。因肾小球滤过率可能下降,需密切监测肾功能。
【肾功能损害】禁忌使用(肌酐清除率≤55mL/min)。
【肝功能损害】说明书中尚未明确。
禁忌症
血清肌酐>1.5mg/dL,肌酐清除率≤55mL/min,尿蛋白≥100mg/dL。
合用其他肾毒性药物(如氨基糖苷类、两性霉素B、膦甲酸、万古霉素、NSAIDs)。
对西多福韦或丙磺舒过敏。
严重磺胺类药物过敏史。
禁止眼内注射。
药物相互作用
1.丙磺舒
影响多种药物代谢或肾排泄(如对乙酰氨基酚、阿昔洛韦、ACE抑制剂、甲氨蝶呤、呋塞米、NSAIDs、茶碱、齐多夫定)。
合用齐多夫定时,应在西多福韦给药日暂停或减量50%。
2.肾毒性药物
禁止与氨基糖苷类、两性霉素B、膦甲酸、静脉喷他脒、万古霉素、NSAIDs合用。
使用西多福韦前至少停用7天。
药物过量
报道2例过量(16.3mg/kg和17.4mg/kg),患者接受丙磺舒和积极水化后未出现显著肾功能变化。
药代动力学
静脉输注后80–100%以原形经尿排泄,肾清除率高于肌酐清除率,提示肾小管分泌。
合用丙磺舒后,肾清除率降至与肌酐清除率一致。
蛋白结合率<6%,脑脊液浓度检测不到。
贮存方法
控温储存于20–25°C(68–77°F)。配制后24小时内使用,可冷藏但不可冷冻。
研发公司
美国吉利德
参考资料:FDA说明书更新于2013年9月,FDA说明书网址:https://nctr-crs.fda.gov/fdalabel/services/spl/set-ids/90639fc6-0295-4115-98f0-054b783850ce/spl-doc?hl=Cidofovir
[ 免责声明 ] 本页面内容来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供持有医疗专业资质的人员用于医学药学研究参考,不构成任何治疗建议或药品推荐。所涉药品可能未在中国大陆获批上市,不适用于中国境内销售和使用。如需治疗,请咨询正规医疗机构。本站不提供药品销售或代购服务。
- 西多福韦的副作用如何缓解西多福韦是一种针对巨细胞病毒视网膜炎的重要抗病毒药物,在发挥疗效的同时可能引发多...[ 详情 ]推荐指数:5152025-07-15 16:08
- 西多福韦的功效与作用西多福韦是一种核苷类似物抗病毒药物,由美国AvetPharma公司研发,1996...[ 详情 ]推荐指数:5522025-07-15 16:08
- 西多福韦的用法用量西多福韦是一种针对巨细胞病毒(CMV)视网膜炎的抗病毒药物,尤其适用于艾滋病患者...[ 详情 ]推荐指数:4892025-07-15 15:26
- 西多福韦的副作用与注意事项西多福韦是一种核苷类似物抗病毒药物,主要针对艾滋病患者的巨细胞病毒(CMV)视网...[ 详情 ]推荐指数:4782025-07-15 15:26
- 西多福韦一次能囤几盒?多少钱?西多福韦是一种用于治疗巨细胞病毒感染的抗病毒药物,尤其适用于免疫功能低下患者。本...[ 详情 ]推荐指数:5932025-04-08 11:39
- 西多福韦在中国上市了吗?好购买吗?导读:西多福韦可用于治疗存在巨细胞病毒(CMV)视网膜炎的获得性免疫缺陷综合征(...[ 详情 ]推荐指数:7402025-04-07 17:54
- 西多福韦有几种规格?多少钱?导读:西多福韦是一种用于治疗特定病毒感染的药物,通过竞争性抑制胞嘧啶,整合于病毒...[ 详情 ]推荐指数:6722025-04-07 17:48
- 西多福韦(Cidofovir)Vistide多少钱一盒西多福韦(Cidofovir)是治疗巨细胞病毒感染的重要抗病毒药物,其价格、购买...[ 详情 ]推荐指数:6452025-04-07 13:36:41
- 西多福韦(Cidofovir)不同版本一盒的最新价格公布目前了解到西多福韦(Cidofovir)有2种版本,包括原研版和仿制版。美国吉利...[ 详情 ]已帮助790人2024-08-13 09:08
- 西多福韦(Cidofovir)孕妇可以用吗?西多福韦(Cidofovir)孕妇一般不可以用。由于西多福韦(Cidofovir...[ 详情 ]已帮助776人2024-08-09 11:51
- 西多福韦(Cidofovir)的有效期是多长时间?西多福韦(Cidofovir)的有效期可能是24个月。通常情况下,在西多福韦(C...[ 详情 ]已帮助765人2024-08-09 09:10:46
- 西多福韦(Cidofovir)最新公布价格美国吉利德生产的西多福韦(Cidofovir)最新价格大约是7980$一盒,一盒...[ 详情 ]已帮助774人2024-08-09 10:44
- 西多福韦(Cidofovir)目前有哪几种版本?目前了解到西多福韦(Cidofovir)有2种版本。西多福韦(Cidofovir...[ 详情 ]已帮助790人2024-08-09 10:44
- Cidofovir全网公布的2024年的最新价格目前了解到Cidofovir全网公布的2024年的最新价格是美国吉利德生产的Ci...[ 详情 ]已帮助762人2024-07-18 11:13
- Cidofovir价格目前了解到Cidofovir只有原研药,没有仿制药,因此也无法得知Cidofov...[ 详情 ]已帮助747人2025-08-18 13:03:18
- 孕妇可以用Cidofovir吗?孕妇一般不可以用Cidofovir。在动物研究中Cidofovir是致畸的,美国...[ 详情 ]已帮助776人2024-07-17 11:38
- PM8002联合紫杉醇对比化疗二线治疗小细胞肺癌[适 应 症]小细胞肺癌[试验分期]Ⅱ期
- ES102联合特瑞普利单抗治疗晚期非小细胞肺癌[适 应 症]非小细胞肺癌[试验分期]Ⅱ期
- 比较Sigvotatug Vedotin与多西他赛治疗既往经治的非小细胞肺癌的研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- QL2107或Keytruda®联合化疗治疗转移性非鳞状非小细胞肺癌的临床研究[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- LM-299注射液单药或联合其它抗肿瘤药物治疗晚期实体瘤[适 应 症]实体瘤[试验分期]Ⅰ期
- SH-1028片对比安慰剂用于非小细胞肺癌辅助治疗[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
做您身边的贴心健康咨询管家

了解医药信息 关注临床动态
- 1苯扎贝特缓释片(Bezafibrate)是治疗什么疾病的已帮助4人2026-03-03 14:35
- 2非布司他(Febuxostat)用法用量说明已帮助5人2026-03-03 14:33
- 3苯扎贝特缓释片(Bezafibrate)的副作用如何缓解已帮助3人2026-03-03 14:32
- 4司拉德帕(seladelpar)的用法用量已帮助3人2026-03-03 14:32
- 5FDA批准卡左双巴缓释片(Sinemet)缓释片用于治疗帕金森病已帮助8人2026-03-03 14:27
- 6卡左双巴缓释片(Sinemet)的副作用和不良反应已帮助7人2026-03-03 14:06
- 7卡左双巴缓释片(Sinemet)的用法用量:用药指南,特殊人群用药已帮助12人2026-03-03 13:52
- 8卡左双巴缓释片(Sinemet)中文说明书已帮助11人2026-03-03 13:45
- 9卡左双巴缓释片(Sinemet)的详细说明书:作用与功效,用法用量,副作用,注意事项等已帮助14人2026-03-03 13:41:08
- 10司拉德帕(seladelpar)怎么购买已帮助9人2026-03-03 11:51
- 112026年司拉德帕(seladelpar)最新价格是多少钱一盒?已帮助10人2026-03-03 11:50
- 12瑞维美尼(Revuforj)的适应症和不良反应已帮助9人2026-03-02 17:59
 恩他卡朋(Entacapone)作为左旋多巴/卡比多巴的辅助用药,适用于原发性帕...[ 详情 ]
恩他卡朋(Entacapone)作为左旋多巴/卡比多巴的辅助用药,适用于原发性帕...[ 详情 ] 舍尼通片(Cernilton)舍尼通片主要用于成年男性慢性前列腺炎及早期良性前...[ 详情 ]
舍尼通片(Cernilton)舍尼通片主要用于成年男性慢性前列腺炎及早期良性前...[ 详情 ] 雌二醇庚酸酯(Progynon-Depot)需为确诊原发性或继发性闭经、子宫发育不全、更年期...[ 详情 ]
雌二醇庚酸酯(Progynon-Depot)需为确诊原发性或继发性闭经、子宫发育不全、更年期...[ 详情 ] 氟维司群(Fulvestrant)适用于HR阳性、HER2阴性的晚期或转移性乳腺癌...[ 详情 ]
氟维司群(Fulvestrant)适用于HR阳性、HER2阴性的晚期或转移性乳腺癌...[ 详情 ]



 医伴旅服务热线:
医伴旅服务热线:
































